contents area
주간건강과질병
detail content area
보툴리눔 독소증 실험실 검사법 연구동향
- 작성일2018-09-20
- 최종수정일2019-09-10
- 담당부서고위험병원체분석과
- 연락처043-719-8270
보툴리눔 독소증 실험실 검사법 연구동향
질병관리본부 감염병분석센터 고위험병원체분석과
전준호, 우선제, 강병학, 이기은*
*교신저자 : gerhie@korea.kr, 043-719-8270
전준호, 우선제, 강병학, 이기은*
*교신저자 : gerhie@korea.kr, 043-719-8270
Abstract
Current development status of laboratory diagnostics of botulism
Jeon Jun Ho, Woo Sun-Je, Kang Byung Hak, Rhie Gi-eun
Division of High-risk Pathogens, Center for Laboratory Control of Infectious Diseases, KCDC
Botulism is a fatal disease caused by botulinum toxins produced by Clostridium botulinum, an anaerobic, Gram-positive bacterium. Botulinum toxins are known to be the deadliest toxins, and induce flaccid paralysis by inhibiting the secretion of acetylcholine, a neurotransmitter in humans. Botulinum toxins are classified into seven toxins ranging from A to G according to their antigenicity. Among them, serotypes A, B, E, and F cause botulism in humans. Botulinum toxin is one of the substances most likely to be used in biological weapons or terrorism because of its high toxicity. In addition, patients with botulism do not comprise a large number of cases worldwide, but because the symptoms are severe, rapid laboratory diagnosis is essential for the treatment of affected patients. To date, a mouse bioassay has been used for laboratory tests of botulism, but alternative testing methods have been required because of animal ethics issues. In this report, we introduce the latest research trends in laboratory diagnostics of botulism.
Keywords: Botulism, Botulinum Toxins, Clostridium botulinum, Laboratory diagnostics, Neurotransmitter
들어가는 말
생물무기에는 인간 또는 동식물에게 사망·고사·질병 등을 유발하는 세균, 바이러스와 같은 미생물 및 독소 등이 포함되며, 1975년 체결된 국제 생물무기 금지협약(Biological Weapons Convention)에 의하여 생물무기는 개발·제조·획득·보유·비축·이전·운송 또는 사용하는 것이 엄격하게 금지되어 있다. 국내에서는 이 협약의 이행을 위하여 「화학무기·생물무기의 금지와 특정화학물질·생물작용제 등의 제조·수출입 규제 등에 관한 법률」(약칭 생화학무기법)을 시행하고 있다. 또한「감염병의 예방 및 관리에 관한 법률」에서 생물테러의 목적으로 이용되거나 사고 등에 의해서 외부로 유출될 경우 국민 건강에 심각한 위협을 초래할 수 있는 보툴리눔균 등 감염병병원체 36종을 고위험병원체로 지정하고, 생물테러에 이용될 가능성과 위해도가 높은 병원체에 의해 유발되는 보툴리눔 독소증 등 8종의 감염병을 ‘생물테러감염병’으로 지정하여 엄격하게 관리하고 있다. 미국 질병관리본부(US Centers for Disease Control and Prevention; US CDC)의 경우에도 잠재적으로 노출될 경우 사람의 건강에 심각한 위협이 될 수 있는 탄저균, 페스트균, 야토균, 보툴리눔균, 보툴리눔 독소 등을 Tier 1 select agents and toxins으로 지정하여 관리 하고 있다[1]. 이와 같이 생물테러에 사용될 가능성이 높은 보툴리눔 독소는 절대혐기성의 그람양성세균인 보툴리눔균(Clostridium botulinum)이 분비하는 독소로 단 1 g 만으로도 백만 명 이상의 사람을 살상할 수 있을 정도로 독성이 강한 것으로 알려져 있다[2]. 실제로 일본의 오움진리교는 1990~1995년 사이에 토양에서 분리한 보툴리눔균에서 독소를 생산하여 적어도 3회 이상의 보툴리눔 독소 테러를 감행한 것으로 알려져 있다[2]. 자연발생 보툴리눔 독소증 환자는 전 세계적으로 많은 수가 보고되고 있지는 않다. 미국의 경우 2016년 205명의 환자가 발생하였으며[3], 유럽연합의 경우 2014년 기준 123명의 환자가 발생하였다[4]. 우리나라의 경우 2003년 3명, 2004년 4명 그리고 2014년 1명의 보툴리눔 독소증 환자가 발생 하였다. 이 단신에서는 보툴리눔 독소증 실험실 검사를 위한 검사법 개발 연구 동향에 대하여 소개하고자 한다.
몸 말
보툴리눔 독소에 의해 유발되는 보툴리눔 독소증(botulism)은 18세기 말에 처음으로 오염된 고기 또는 소시지를 섭취할 경우 발생될 수 있다는 사실이 알려졌으며, 1895년 벨기에의 과학자 Emile Pierre van Ermengem에 의해 보툴리눔 독소증의 원인균으로 보툴리눔균이 처음으로 분리되었다[5]. 1897년 Bacillus botulinum으로 명명되었다가 20세기 초 Clostridium botulinum으로 명칭이 바뀌었다[5]. 보툴리눔 독소는 150 kDa의 단일 폴리펩타이드 사슬로 만들어진 후 단백질 분해효소에 의해 단일 이황화결합으로 연결된 이중사슬로 나뉘게 된다. 이와 같은 이중사슬은 펩타이드 내부분해효소(endopeptidase) 활성을 가지고 있는 50 kDa의 경쇄와 독소의 세포내 이동에 관여하는 100 kDa의 중쇄(Heavy chain; HC)로 구성된다(Figure 1)[6].
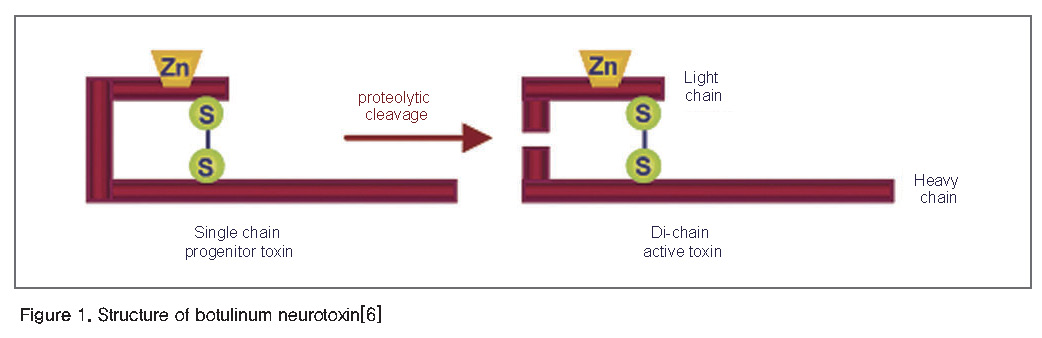
보툴리눔 독소는 항원성에 따라 7개의 독소형(A~G)으로 구분되며, 이들 독소형에서 A, B, E, F가 사람에게서 독소증을 유발하는 것으로 알려져 있다. 보툴리눔 독소는 수용체 결합(Receptor binding), 세포도입(Internalization), 막 이동(Membrane translocation), 세포내부 운송(Intracellular trafficking), SNARE(Soluble N-ethylmaleimide-sensitive factor attachment protein receptor) 단백질(Synaptic-associated proteins of 25 kDa(SNAP-25), synaptobrevin, syntaxin)의 분해과정을 통하여 신경전달물질인 아세틸콜린의 분비를 억제하고 그 결과 이완마비를 유도함으로써 보툴리눔 독소증을 유발하게 된다(Figure 2)[7].
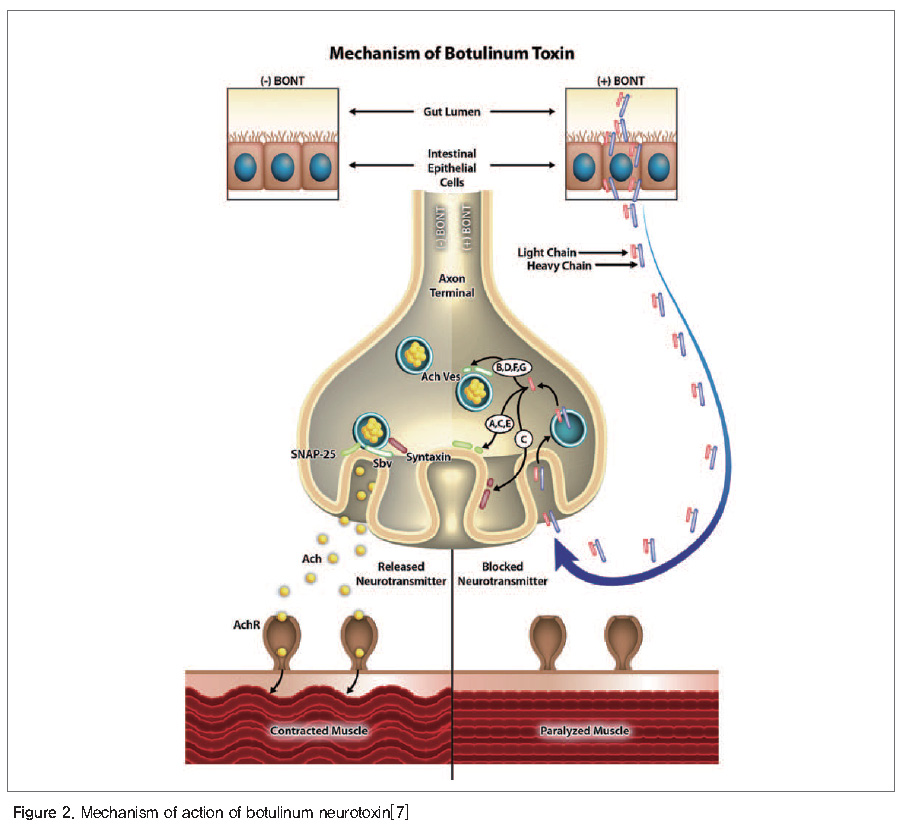
사람의 경우 일반적으로 임상증상이나 획득경로에 따라 음식물 유래, 상처, 영아 또는 장 보툴리눔 독소증의 세 가지 형태로 분류한다. 임상증상은 하행성 양측성 마비가 특징이며, 이중착시, 흐릿한 시야, 구강건조로 시작하여 발음장애, 연하곤란, 안면마비로 진행되며 심한 경우 호흡근과 흉근의 마비로 사망할 수 있다. 보툴리눔 독소증 환자는 중환자실에서 호흡유지로 2~8주간의 집중 치료가 필요하다[2].
보툴리눔 독소 실험실 진단 검사방법 연구동향
마우스 바이오어세이(Mouse bioassay) 검사법
마우스 바이오어세이 검사법은 보툴리눔 독소증 실험실 검사의 표준검사법(Gold standard)으로 7가지 독소형을 모두 민감하게 검출할 수 있는 검사법이다. 보툴리눔 독소증 의심환자의 검체를 마우스의 복강에 중화항체와 함께 주사하고 보툴리눔 독소의 존재 유무 및 독소형을 확인하는 검사법이다. 또한 10~20 pg/ml의 보툴리눔 독소를 검출할 수 있을 정도로 매우 민감한 실험법이다[8]. 현재 질병관리본부에서는 이 검사법을 이용하여 실험실 검사를 수행하고 있다. 이 검사법은 고감도로 보툴리눔 독소를 확인할 수 있는 방법이지만 검사를 위하여 최소 4일 이상의 시간이 소요되며 실험동물과 이들을 사육할 수 있는 시설 그리고 숙련된 검사자가 필요하다.
ELISA(Enzyme-Linked Immunosorbent Assay) 검사법
ELISA 검사법은 독소형 확인 및 독소 정량을 위하여 가장 널리 사용되는 in vitro 검사법 중 하나로 항원-항체 결합을 기반으로 하는 검사법이다[9]. ELISA 검사법 중 sandwich ELISA법은 독소 검출을 위하여 보툴리눔 독소 특이적인 capture와 detection 항체를 사용하며 독소를 민감하게 검출할 수 있다. 또한 고감도 보툴리눔 독소 검출을 위하여 detection 항체에 발광 또는 형광 신호를 나타내는 효소를 결합하거나 biotin과 streptavidin 결합을 이용한다[7]. 이와 더불어 민감도 증대를 위하여 고감도 ELISA 항체가 개발되고 있으며 증폭 ELISA(amplified ELISA), 단일 도메인 항체 ELISA(sdAb-ELISA; single domain antibody-ELISA), 펩타이드 ELISA(peptide-ELISA)와 리포좀 ELISA(liposome-ELISA)와 같은 변형 ELISA 검사법이 개발되고 있다.
증폭 ELISA(Amplified ELISA) 검사법
이 검사법은 기존의 ELISA 검사법의 최종 효소반응 산물을 증폭시키는 방법으로 digoxigenin-ELISA (DIG-ELISA)법이 대표적이다. DIG-ELISA는 미국 식품의약품안전청(US Food and Drug Administration, FDA)와 미국 질병관리본부에 의해 개발된 방법으로 Laboratory Response Network(LRN)와 Food Emergency Response Network(FERN)에 가입되어 있는 공중보건실험실에서 음식물, 혈청과 환경시료에서 보툴리눔 독소 A, B, E, F를 검출하기 위해 사용하고 있다[7,9]. 이 검사법에서는 각 보툴리눔 독소에 특이적인 2개의 항체를 capture와 detection 항체로 사용하고 HRP(horseradish peroxidase)가 결합되어 있는 DIG 항체를 사용하여 신호를 증폭시키는 방법이다. DIG-ELISA는 보툴리눔 독소의 혈청형에 따라 마우스 바이오어세이의 1~10 MLD(Median lethal dose)까지 검출할 수 있는 민감도가 높은 검사법이다. 또한 다른 혈청형의 독소와 교차반응이 관찰되지 않으며 6시간 이내에 보툴리눔 독소 존재 여부를 확인할 수 있다는 장점이 있다.
단일 도메인 항체 ELISA(sdAb-ELISA) 검사법
이 검사법은 미 해군 연구소(US Naval Research Laboratory)에 의해 개발된 방법으로 biotin이 결합되어 있는 라마(Llama) 기원 보툴리눔 독소 단일 도메인 항체를 사용하는 방법이다[10]. 형광 염색시료가 결합된 파아지 발현(phage-displayed) 단일 도메인 항체를 사용할 경우 10배 이상 민감도가 향상되는 것으로 알려져 있다[7].
펩타이드 ELISA(Peptide-ELISA) 검사법
펩타이드 라이브러리 스크리닝을 통하여 확보한 보툴리눔 독소 특이적인 환상 펩타이드(cyclic peptide)를 polyethylene maleic anhydride(PEMA)에 고정하고 보툴리눔 독소 특이적인 다클론 항체를 이용하여 독소를 검출하는 검사법이다[7]. 보툴리눔 독소 A에 특이적인 환상 펩타이드인 C11-019와 고감도 형광염색시료를 사용할 경우 3시간 안에 보툴리눔 독소 A를 1 pg/ml까지 검출할 수 있음이 보고되었다[11].
리포좀 ELISA(Liposome-ELISA) 검사법
이 ELISA 검사법은 detection 항체 대신에 ganglioside를 포함하는 리포좀을 사용하여 독소를 검사하는 방법이다[11]. Ganglioside는 신경세포 등의 표면에 존재하는 수용체로 박테리아가 생산하는 독소와 특이적으로 결합하는 것으로 알려져 있으며, 보툴리눔 독소의 경우 ganglioside GT1b에 결합한다. 이 검사법은 리포좀의 비특이적 결합으로 150 ng/ml의 보툴리눔 독소 A를 검출할 수 있을 정도로 민감도가 높지 않았으나 캡슐화된 DNA를 리포좀 내로 도입하고 PCR 방법을 추가한 liposome-PCR 방법을 사용하여 0.02 fg/ml까지 검출할 수 있음이 보고되었다[12].
Immuno-PCR 검사법
이 검사법은 sandwich ELISA를 기반으로 detection 항체에 기존의 효소 대신 DNA를 결합하고 PCR을 수행함으로써 기존의 ELISA 검사법의 민감도를 증진시킬 수 있는 방법이다. 이 검사법을 사용하여 보툴리눔 독소 검출 시 기존의 ELISA 검사법 대비 약 1,000배의 민감도가 증대될 수 있음이 보고되었으며, 표준 검사법인 마우스 바이오어세이와 동등한 수준까지 독소를 검출할 수 있음이 보고되었다[13]. 최근에는 biotin/streptavidin을 결합한 항체와 DNA를 사용하여 1 pg/ml의 보툴리눔 독소 A를 검출할 수 있음이 보고되었다[7].
유세포분석기 검사법(Flow cytometry assay)
이 검사법은 형광이 결합된 보툴리눔 독소 특이 항체 및 유세포 분석기를 이용하여 보툴리눔 독소를 검사하는 방법이다. 다양한 형광염색시료가 결합된 항체를 이용한 독소 다중검사가 가능하며, 높은 민감도로 보툴리눔 독소를 검출할 수 있는 것으로 알려져 있다. 실제로 보툴리눔 독소 A와 B를 ricin, abrin, SEB와 함께 음식물과 혼합하여 실험하였을 경우에도 각각 21 pg/ml와 73 pg/ml의 검출한계를 나타냈다[14]. 이 검사법은 높은 민감도와 독소 다중검출이 가능하나 고가의 장비가 필요하다.
면역크로마토그래피 검사법(Immunochromatography assay)
면역크로마토그래피 검사법에는 대표적으로 측면유동 검사법(Lateral flow assay)과 컬럼 유동 검사법(Column flow assay)이 있다. 두 가지 방법 모두 특별한 장비 없이 현장에서 쉽고 빠르게 보툴리눔 독소를 검사할 수 있는 방법이다. 측면유동 검사법은 나이트로셀룰로오스 스트립(Nitrocellulose strip) 상의 샘플 패드에 독소를 포함하는 시료를 로딩하면 항체와 결합 후 모세관현상에 의해 반대편으로 흘러가게 되는데 시료에 보툴리눔 독소가 존재할 경우 스트립에 고정되어 있는 보툴리눔 독소 특이 항체와 결합하여 색 변화가 유도되고 이를 통하여 양성 여부를 확인하는 검사법이다[7]. 측면유동 검사법은 복잡한 장비와 숙련된 검사자를 필요로 하지 않으며 15분 이내에 검사가 가능하다는 장점을 가지고 있다. 이 검사법의 검출한계는 독소형에 따라 다르지만 5~50 ng/ml로 알려져 있다[7]. 컬럼 유동 검사법의 대표적인 방법은 면역친화 크로마토그래피(Immunoaffinity chromatography)로 보툴리눔 독소에 특이적인 capture 항체를 컬럼에 미리 넣은 후 독소를 포함하는 시료와 보툴리눔 독소 특이적 detection 항체를 순차적으로 넣고 색 변화를 유도하는 검사법이다. 독소형에 따라 0.5~50 ng/ml의 검출한계를 보이는 것으로 알려져 있다[7]. 이 검사법은 낮은 농도의 독소가 포함된 시료(~10 ml)를 농축하여 검사할 수 있다는 장점을 가지고 있다.
압타머-전기화학 검사법(Aptamer-Electrochemical assay)
이 검사법은 효소 증폭과 압타머 기술을 통합한 전기화학 검사법이다. 이 검사법에 프로브로 사용되는 압타머는 biotin과 형광 두 가지가 결합되어 있어, 여기에 보툴리눔 독소가 결합하게 되면 구조적인 변화가 유도되고 이러한 변화가 전기화학 신호로 기록되는 검사법이다. 이 검사법을 이용하여 보툴리눔 독소 A를 40 pg/ml까지 검출할 수 있는 것으로 보고되었다[15].
펩타이드 내부분해효소 질량분석(Endopeptidase-mass spectrometry) 검사법
이 검사법은 보툴리눔 독소 경쇄에 의해 SNARE 단백질과 같은 기질 단백질이 분해되는 특성을 이용하는 방법이다. 이 검사법에서는 SNARE 단백질 대신에 합성 펩타이드를 기질로 사용한다. 시료에 보툴리눔 독소가 존재하여 작은 펩타이드로 나뉘게 되면 이를 질량분석을 통하여 분석하는 검사법이다[16]. 또한 독소형 확인을 위하여 각 독소형 특이 항체를 capture 항체로 사용하게 된다. 이 검사법은 0.1~10 MLD까지 독소를 검출할 수 있는 것으로 알려져 있다. 매우 민감도가 높은 검사법이나 분석을 위한 검체 처리 시간이 길며 고가의 장비를 사용해야 하며, 숙련된 검사자를 통한 분석이 이루어져야 한다는 단점이 있다
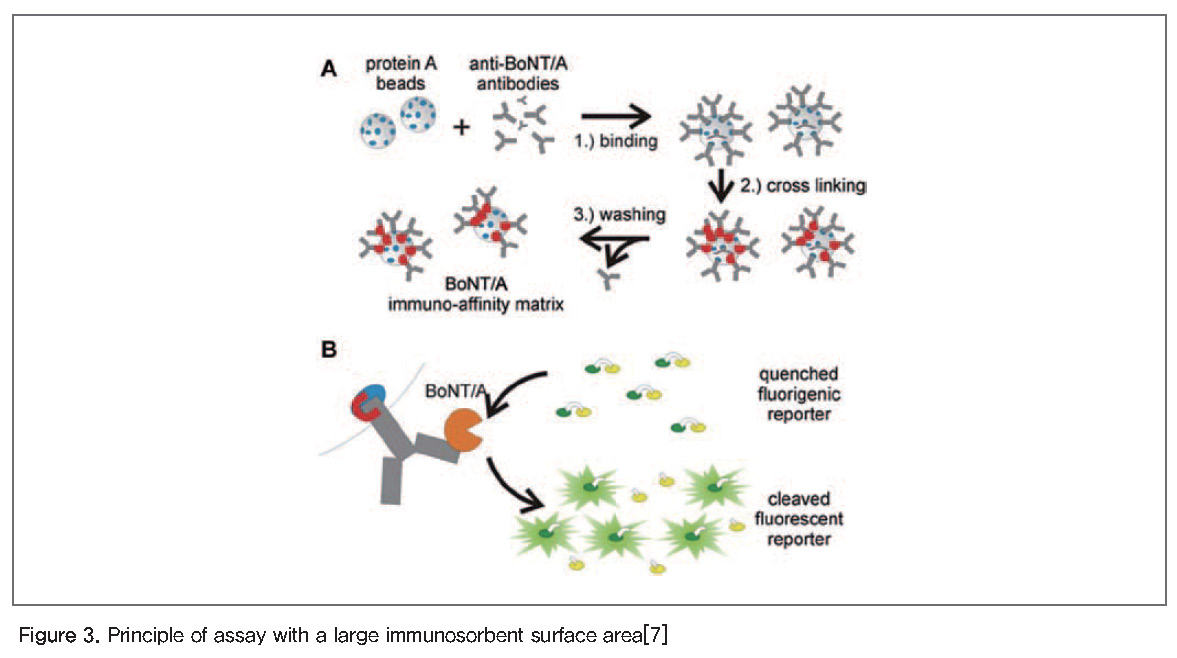
ALISSA(Assay with a large immunosorbent surface area) 검사법
이 검사법은 시료에서 보툴리눔 독소 경쇄에 특이적인 항체가 결합된 비드를 이용하여 독소를 모은 후 형광이 결합된 SNAP-25(SNAPtide)를 기질로 사용하여 반응시킨 후 형광을 측정하는 방법이다. 시료에 보툴리눔 독소가 존재하면 SNAPtide가 절단되어 quencher가 붙어 있는 펩타이드가 떨어져 나가고 형광이 결합된 펩타이드가 방출되어 독소 존재 여부를 검사하는 방법이다(Figure 3)[17]. 이 검사법은 마우스 바이오어세이 검사법보다 우수하여 0.5 fg/ml의 보툴리눔 독소 A를 검출할 수 있는 것으로 보고되었다.
PCR(Polymerase chain reaction) 검사법
PCR 검사법은 DNA를 기반으로 conventional PCR 또는 real-time PCR을 수행하여 신속·고감도로 보툴리눔균 독소 유전자 또는 독소 관련 유전자를 검출하는 방법이다. 이를 통하여 직접적으로 독소형 확인이 가능하나 임상시료에 보툴리눔균 또는 포자가 존재할 경우에만 검출이 가능하고 독소만이 존재할 경우에는 검출이 불가능한 단점이 있다. 따라서 현재까지는 보툴리눔 독소증 진단을 위한 보조 검사법으로 사용되고 있다. 최근에는 보툴리눔 독소 A, B, E, F를 동시에 검출할 수 있는 검사법이 개발되었다[7].
맺는 말
현재 보툴리눔 독소증 실험실 검사를 위해서는 마우스를 이용한 바이오어세이법이 사용되고 있으며, 현재까지 전 세계적인 표준검사법으로 사용될 정도로 높은 민감도와 정확성을 갖는 검사법이다. 실제로 세계보건기구(World Health Organization, WHO)와 미국 질병관리본부에서는 보툴리눔 독소증 확인 검사법으로 마우스 바이오어세이를 활용하고 있다. 그럼에도 불구하고 마우스 바이오어세이 검사법은 독소증 여부 확인을 위해 최소 3~5일의 시간이 필요하며, 동물의 희생을 필요로 하는 문제가 있다. 또한 동물을 사용하기 때문에 다양한 검체를 동시에 검사하는 것이 어려운 단점이 있다. 앞서 설명한 바와 같이 현재 보툴리눔 독소증 실험실 검사를 위한 신속·고감도의 다양한 검사법이 개발·보고되고 있으며, 심지어 마우스 바이오어세이 검사법 보다 민감도가 높은 검사법들이 개발되고 있다. 따라서 질병관리본부는 보툴리눔 독소증 실험실 검사를 위한 신속·고감도 검사법 및 현장에서 이용 가능한 검사법을 개발하고 검증함으로써 국가 생물테러 대비·대응 및 진단검사 능력을 강화해 나갈 예정이다.
참고문헌
1. https://www.selectagents.gov/SelectAgentsandToxinsList.html. Select Agents and Toxin Lists.
2. Stephen S. Arnon, Robert Schechter, Thomas V. Inglesby, Donald A Henderson, John G. Bartlett, et al. Botulinum Toxin as a Biological Weapon. JAMA. 2001;285(8):1059-1070.
3. https://www.cdc.gov/botulism/surveillance.html. National Botulism Surveillance Summary 2016.
4. https://ecdc.eurapa.eu/en/publications-data/botulism-annual-epidemiological-report-2016-2014-data. Botulism-Annual Epidemiological Report, 2016[2014 data].
5. F. J. Erbguth. From poison to remedy: the chequered history of botulinum toxin. Journal of Neural Transmission. 2008;115(4):559-565.
6. Annica Tevell Aberg, Kristian Bjornstad, Mikael Hedeland. Mass spectrometric detection of protein-based toxins. biosecurity and bioterrorism: biodefense strategy, practice, and science. 2013;11(Suppl 1):S215-S226.
7. Ajay K. Singh, Larry H. Stanker, Shashi K. Sharma. Botulinum neurotoxin: Where are we with detection technology? Critical Reviews in Microbiology. 2013;39(1):43-56.
8. Ferreira JL. Comparison of amplified ELISA and mouse bioassay procedures for determination of botulinal toxins A, B, E, and F. Journal of AOAC International. 2001;84(1):85-88.
9. Cai S, Singh BR, Sharma S. Botulism diagnostics: from clinical symptoms to in vitro assays. Critical Reviews in Microbiology. 2007;33(2):109-125.
10. Goldman ER, Anderson GP, Conway J, Sherwood LJ, Fech M, Vo B, Liu JL, Hayhurst A. Thermostable llama single domain antibodies for detection of botulinum A neurotoxin complex. Analytical chemistry. 2008;80(22):8583-8591.
11. Stenmark P, Dupuy J, Imamura A, Kiso M, Stevens RC. Crystal structure of botulinum neurotoxin A in complex with the cell surface co-receptor GT1b-insight into the toxin-neuron interaction. PLoS Pathogen. 2008;4:e1000129.
12. Mason JT, Xu L, Sheng ZM, O’Leary TJ. A liposome-PCR assay for the ultrasensitive detection of biological toxins. Nature Biotechnolology. 2006;24:555-557.
13. Wu HC, Huang YL, Lai SC, Huang YY, Shaio MF. Detection of Clostridium botulinum neurotoxin type A using immuno-PCR. Letters in Applied Microbiology. 2001;32(5):321-325.
14. Pauly D, Kirchner S, Stoermann B, Schreiber T, Kaulfuss S, Schade R, Zbinden R, Avondet MA, Dorner MB, Dorner BG. Simultaneous quantification of five bacterial and plant toxins from complex matrices using a multiplexed fluorescent magnetic suspension assay. Analyst. 2009:134:2028-2039.
15. Wei F, Ho CM. Aptamer-based electrochemical biosensor for Botulinum neurotoxin. Analytical and Bioanalytical Chemistry. 2009;393(8):1943-1948.
16. Kalb SR, Garcia-Rodriguez C, Lou J, Baudys J, Smith TJ, Marks JD, Smith LA, Pirkle JL, Barr JR. Extraction of BoNT/A, /B, /E, and /F with a single, high affinity monoclonal antibody for detection of botulinum neurotoxin by Endopep-MS. PLoS ONE. 2010;5(8):e12237.
17. Karine Bagramyan, Jason R. Barash, Stephen S. Arnon, Markus Kalkum. Attomolar Detection of Botulinum Toxin Type A in Complex Biological Matrices. PLoS ONE. 2008;3(4):e2041.
 본 공공저작물은 공공누리 "출처표시+상업적이용금지+변경금지" 조건에 따라 이용할 수 있습니다.
본 공공저작물은 공공누리 "출처표시+상업적이용금지+변경금지" 조건에 따라 이용할 수 있습니다.