contents area
주간건강과질병
detail content area
혈소판제제 장기보존을 위한 냉장혈소판제제 유효성 검토 연구
- 작성일2019-05-23
- 최종수정일2019-09-10
- 담당부서혈액안전감시과
- 연락처043-719-7660
혈소판제제 장기보존을 위한 냉장혈소판제제 유효성 검토 연구
전북대학교병원 진단검사의학과
조용곤
질병관리본부 장기이식관리센터 혈액안전감시과
양진혁, 김민주, 김준년*
*교신저자 : drlord@korea.kr, 043-719-7660
조용곤
질병관리본부 장기이식관리센터 혈액안전감시과
양진혁, 김민주, 김준년*
*교신저자 : drlord@korea.kr, 043-719-7660
Abstract
The effectiveness of platelet cold-storage for long-term preservation
Cho Yong Gon
Department of Laboratory Medicine, Medical School of Chonbuk National University
Yang Jin Hyuk, Kim Min-Ju, Kim Jun-nyun
Division of Human Blood Safety Surveillance, Center for Organ Transplant Management, KCDC
The room temperature storage of platelets contributes to platelet storage lesion (PSL) and the risk of bacterial growth. To increase shelf life and improve safety in transfusion, an alternative storage method is needed for platelet concentrates (PCs) and apheresis platelets. In a previous study, refrigeration storage of platelets with N-acetylcysteine (NAC) potentially prevented the development of PSL. This current investigation was designed to assess the efficacy of NAC and ascorbic acid (Vitamin C) as anti-platelet compounds during extended PC storage. The use of NAC and ascorbic acid was found to moderate the development of PSL and enhance in vivo recovery of refrigerated platelets in a similar style to PCs stored at room temperature. The positive effect of NAC and ascorbic acid on refrigerated PCs was suggested to be via regulation of reactive oxygen species, platelet activation, and sialic acid channels. The findings of this study might extend PC storage by up to 10 days.
Keywords: Ascorbic acid, Cold-stored platelets, Long-term preservation, N-acetylcysteine, Platelet concentrates
들어가는 말
생체에서 약 10일의 수명을 갖는 혈소판은 실온(22±2℃)에 보존하면 수혈 후에도 비교적 오래 생존하지만, 실온에서는 혈소판저장병변(platelet storage lesion, PSL)의 발생과 세균오염의 위험이 있어 5일(120시간)까지만 보관한다. 전혈이나 적혈구에 비해 훨씬 짧은 보존기간으로 충분한 혈소판을 적시에 공급하기 어렵고, 환자 상태가 호전되거나 수혈이 불가능한 사태가 발생하면 사용하지 못한 혈소판은 대부분 폐기하고 있어 장기보존 전략이 필요하다. 특히 실온보관에 따른 혈소판의 세균오염 가능성은 수혈자의 면역력이 저하되어있는 경우가 많기에 치명적인 부작용으로 이어질 수 있다. 이를 예방하기 위한 병원균 불활화 기술도 혈소판저장병변의 진행을 막지 못하였고, 이를 억제하는 혈소판보존액(platelet additive solution)은 혈소판 수명 연장에 큰 효과를 거두지 못하였다. 냉장혈소판의 수혈 후 제거 기전이 규명되고 미국 식품의약국(Food and Drug Administration, FDA)이 저온 저장된 액상 혈소판을 활동성 출혈 환자의 지혈 목적으로 사용 승인함에 따라 혈소판의 냉장 보존으로 세균오염의 위험을 줄이면서 그 수명도 연장시킬 가능성이 열렸다.
혈소판의 대사속도를 저하시키는 냉장 보존으로 혈소판이 활성화하고 세포 모양이 변하며 지혈기능은 상승 또는 유지하게 한다. 탈과립으로 인한 혈소판막 표면의 당단백 clustering과 탈시알화(desialization)가 냉장 보존된 혈소판이 수혈 후에 빠르게 제거되는 주요 인자로 생각되고 있다. 이를 억제하는 물질을 발굴하여 첨가함으로써, 냉장혈소판제제를 장기 보존할 수 있을 것이다.
아스코르빈산(비타민 C)과 n-acetylcysteine(NAC)과 같은 항산화물질은 활성산소종(reactive oxygen species, ROS)을 소거하여 혈소판 저장 중에 활성산소로 인한 세포 손상과 세포 자멸로부터 세포를 보호하고 혈소판에 대한 항응집 효과가 있다. 선행연구에서 NAC 첨가 냉장혈소판으로 품질을 향상시켰고, 아스코르빈산과 NAC의 항균 효과와 탈시알화 억제를 관찰하였다. 저자들은 냉장혈소판의 장기보존과 관련하여 냉장혈소판에 아스코르빈산와 NAC를 처리하여 그 유효성을 연구하였다.
몸 말
연구대상 및 방법
1. 혈소판 제제의 준비
연구의 모든 과정은 연구윤리심의위원회의 승인(IRB No. CUH2017-08-034)에 따라 수행하였고, 건강한 성인남성 헌혈자 5명의 서면동의하에 성분채혈혈소판(1인당 약 250 ml)을 자동화 시스템(Fenwal Amicus separator, Fresenius Kabi, USA)을 이용하여 채취 및 수집하였다. 채취한 혈소판을 20 ml씩 30 ml의 가스 투과성 백에 무균적으로 분주하여 50 mM NAC와 100 μM 아스코르빈산을 처리하여 PC-NAC와 PC-AA로 나누었다. 실온(RT) 및 냉장 온도(RC)에서 수평 교반으로 최대 12일까지 저장하며 각 군의 차이를 측정하였다(Figure 1).
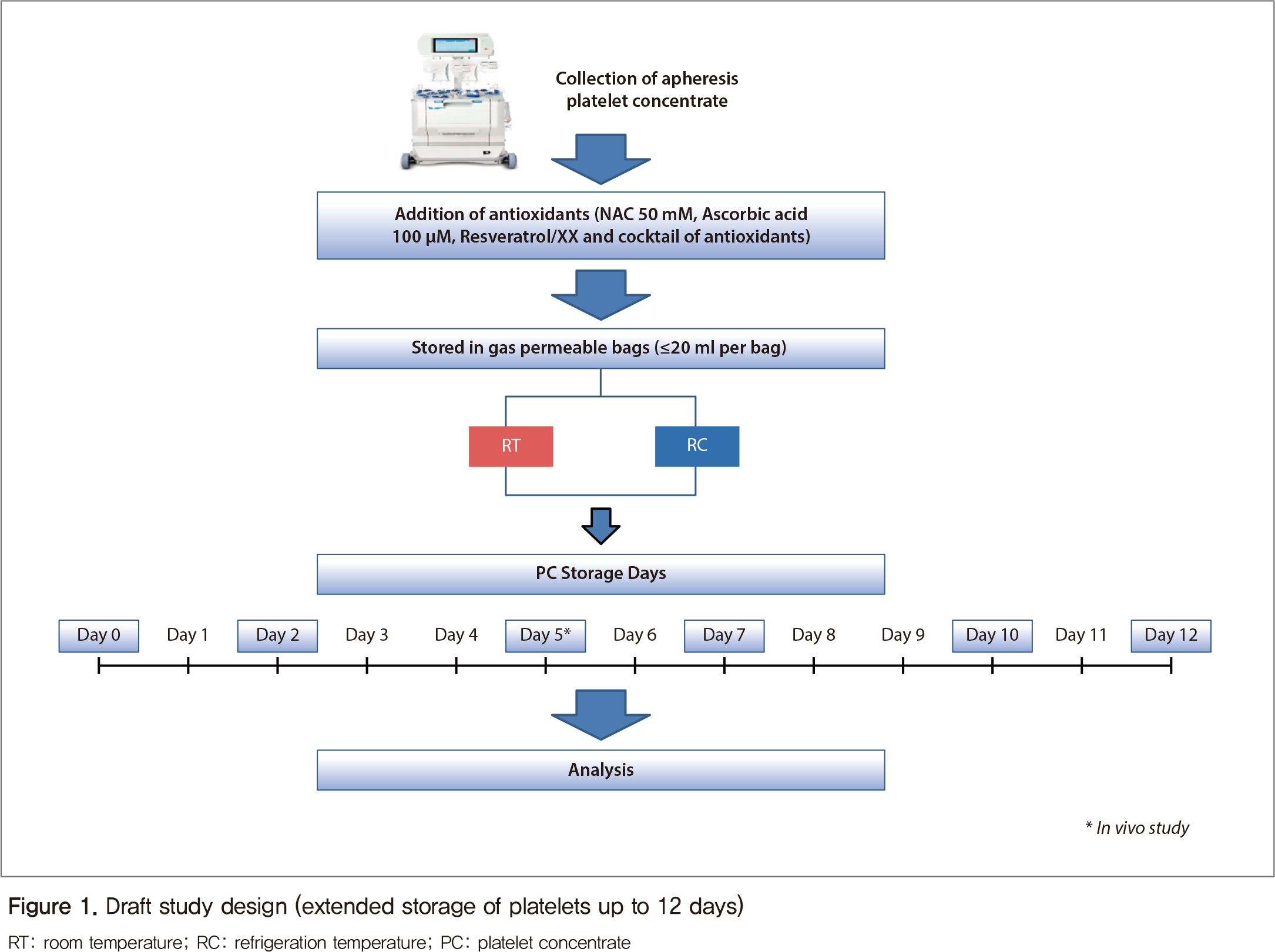
2. 검사방법
(1) 생체 외 분석
실온 및 냉장 혈소판의 보관조건과 기간에 따라 혈소판 수와 활동성(swirling index), 활성화(CD62P), 혈소판막 당단백인 GPIbα(CD42b) 표현정도, Annexin V 결합정도, glycan exposure 그리고 sialidase activity를 측정하고, 혈소판 보존액 내의 대사지표 변화로 pH와 lactate, glucose 농도, reactive oxygen species(ROS) 수준을 측정하였다. 인간 간세포암 세포주(human hepatocarcinoma cell line, HepG2)를 이용하여 ingestion assay를 시행하였다.
(2) 생체 내 분석
수혈 후 혈소판의 생존율을 분석하기 위해 humanized mice(NOD/SCID mice: NOD.CB17-Prkdcscid/NCrKoat)를 이용하여 사람 혈소판을 주입하고 주사 후 2시간과 24시간의 회수율을 측정하였다. 사람 혈소판은 형광 처리된 혈소판 특이 항체로 표지하여 주사 후 동물로부터 채취하여 분리, 고정하고 anti-human CD41a 항체를 유세포 분석하였다.
연구 결과
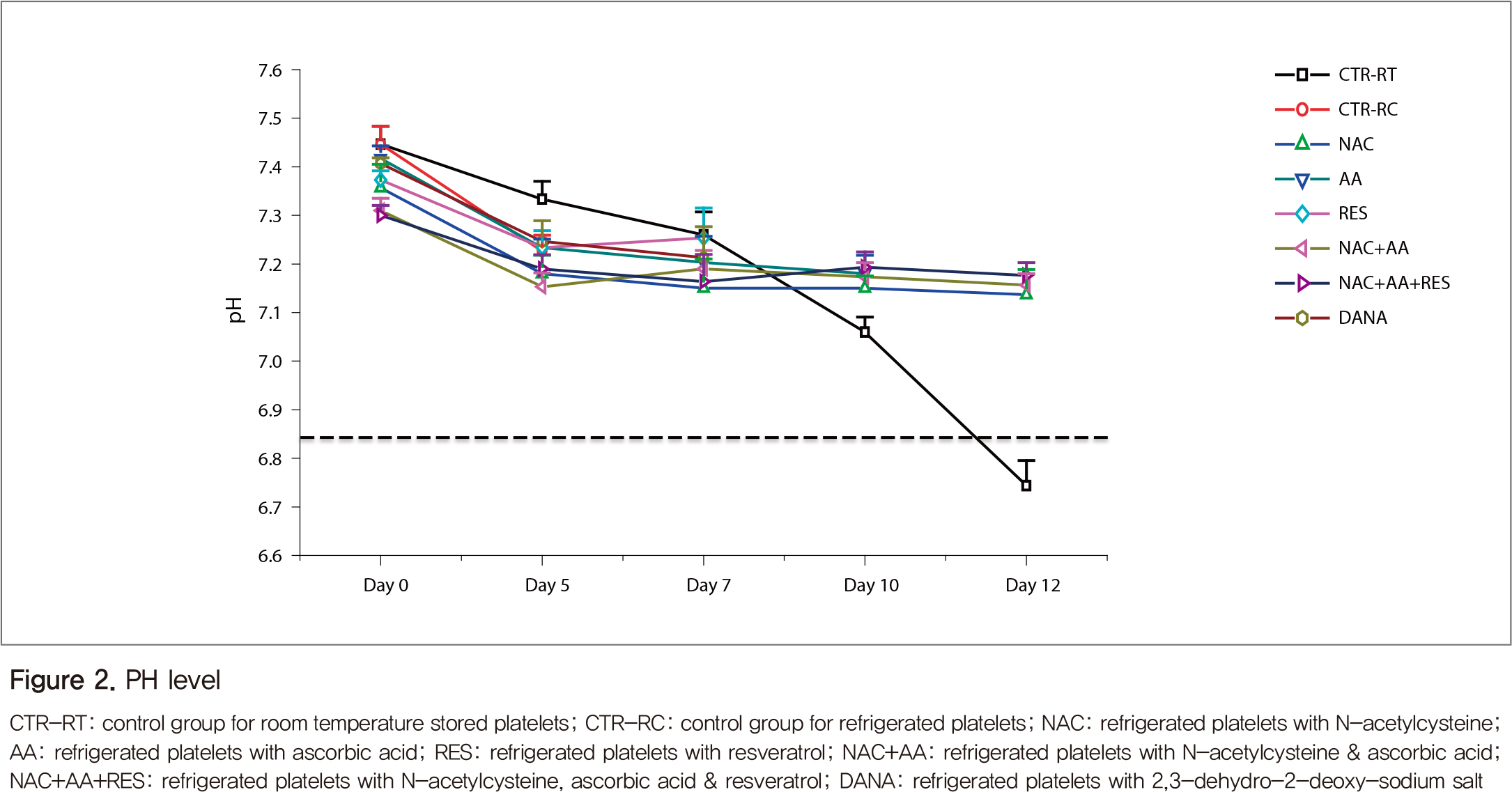
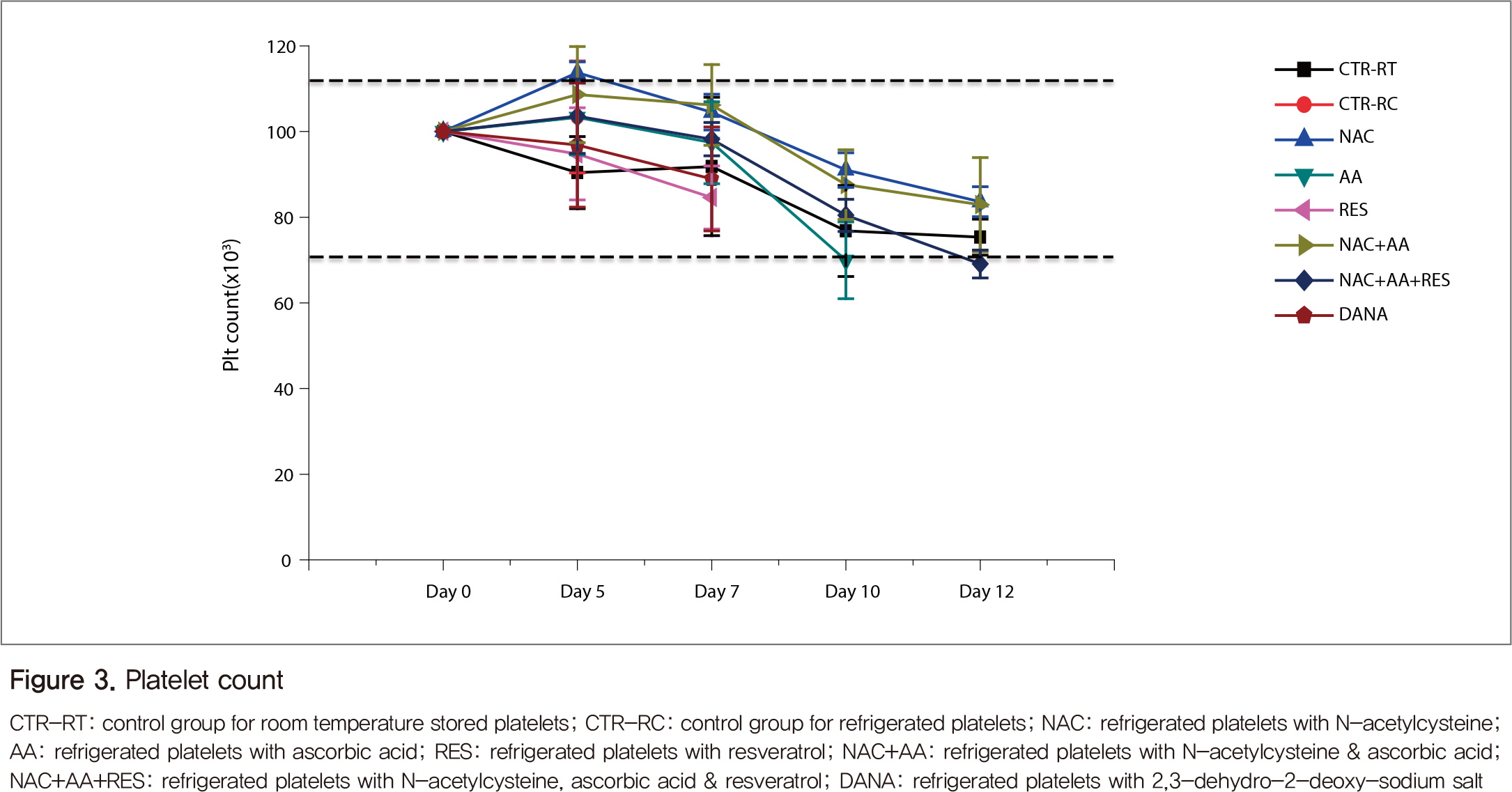
생체 외 분석 결과, 혈소판 보관백 내의 pH는 보존기간 동안 큰 변화를 보이지 않았으나, 정상대조군으로 사용한 실온보존 혈소판은 꾸준히 감소하여 보관 12일에는 6.8 미만으로 감소하였다(Figure 2). 혈소판 수는 큰 변화를 보이지 않다가 7일 이후부터 감소하는 경향을 보였다(Figure 3).
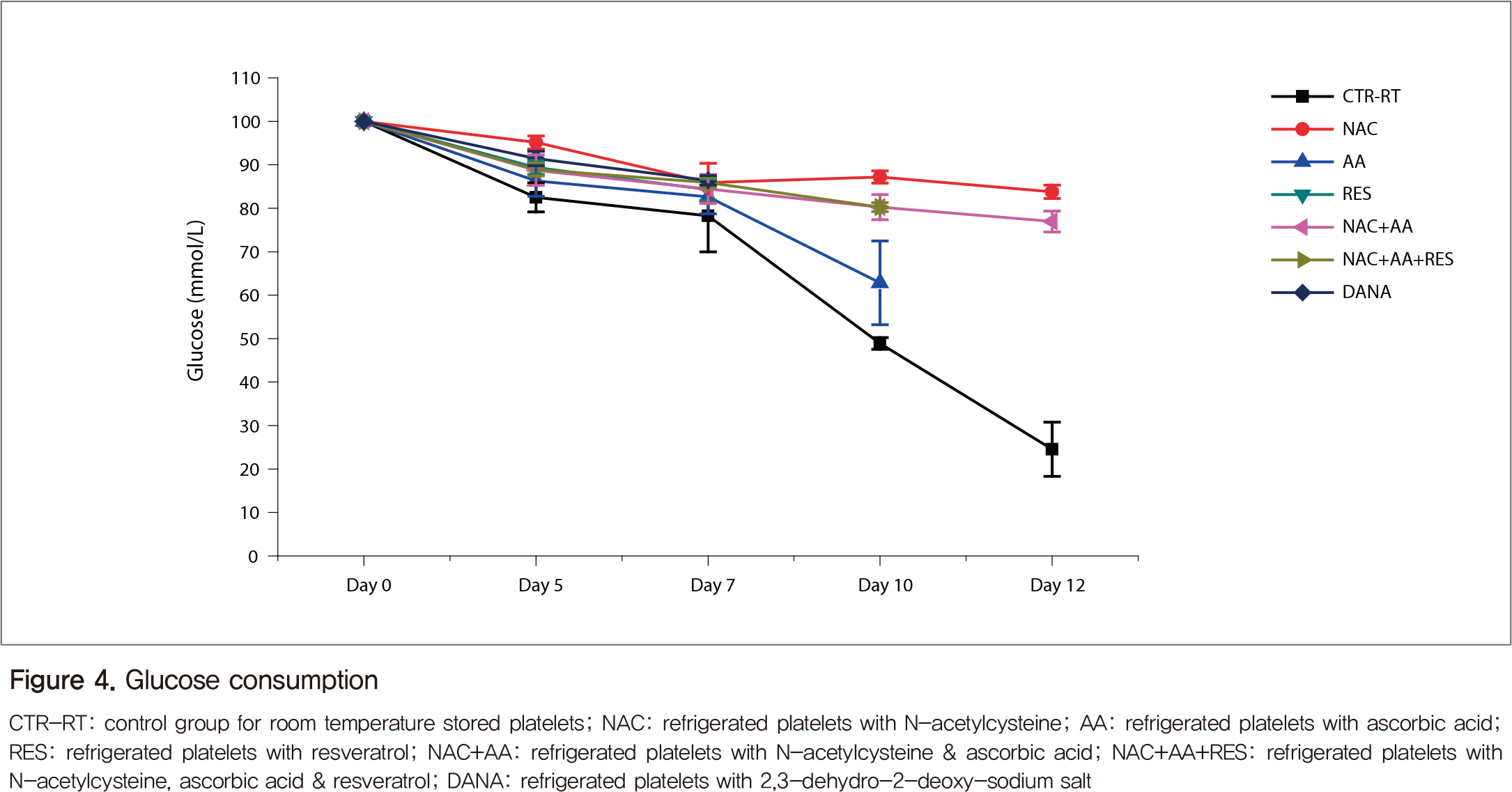
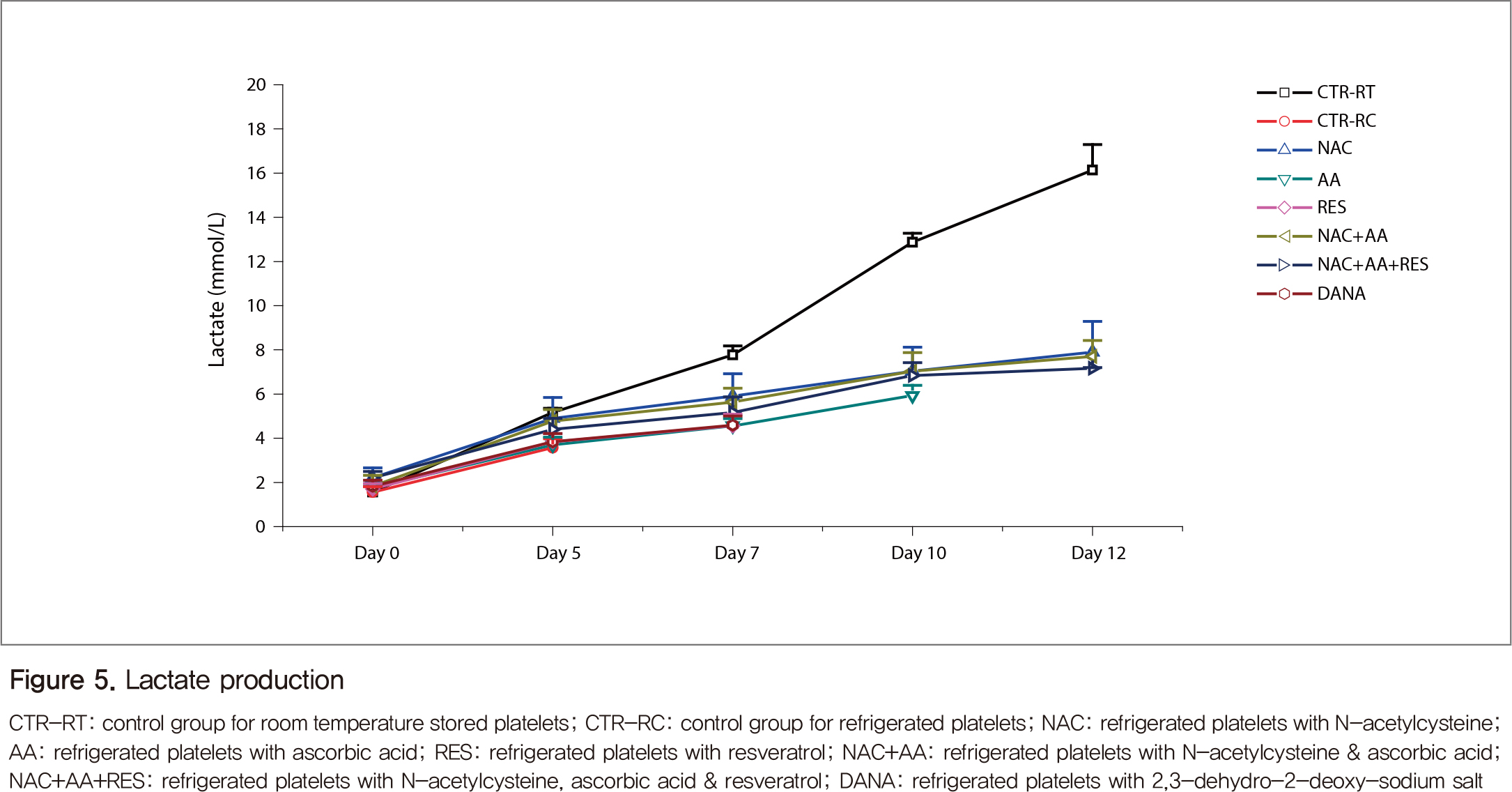
Glucose 농도는 보관 7일째까지는 크게 변하지 않았으나, 비타민 C를 넣은 냉장혈소판과 특히 실온혈소판(대조군)은 10일 이후 급격한 감소를 보였다(Figure 4). Lactate 농도는 glucose 농도와 반대 양상을 보여, 실온혈소판은 7일째부터 급격하게 증가하였다(Figure 5).
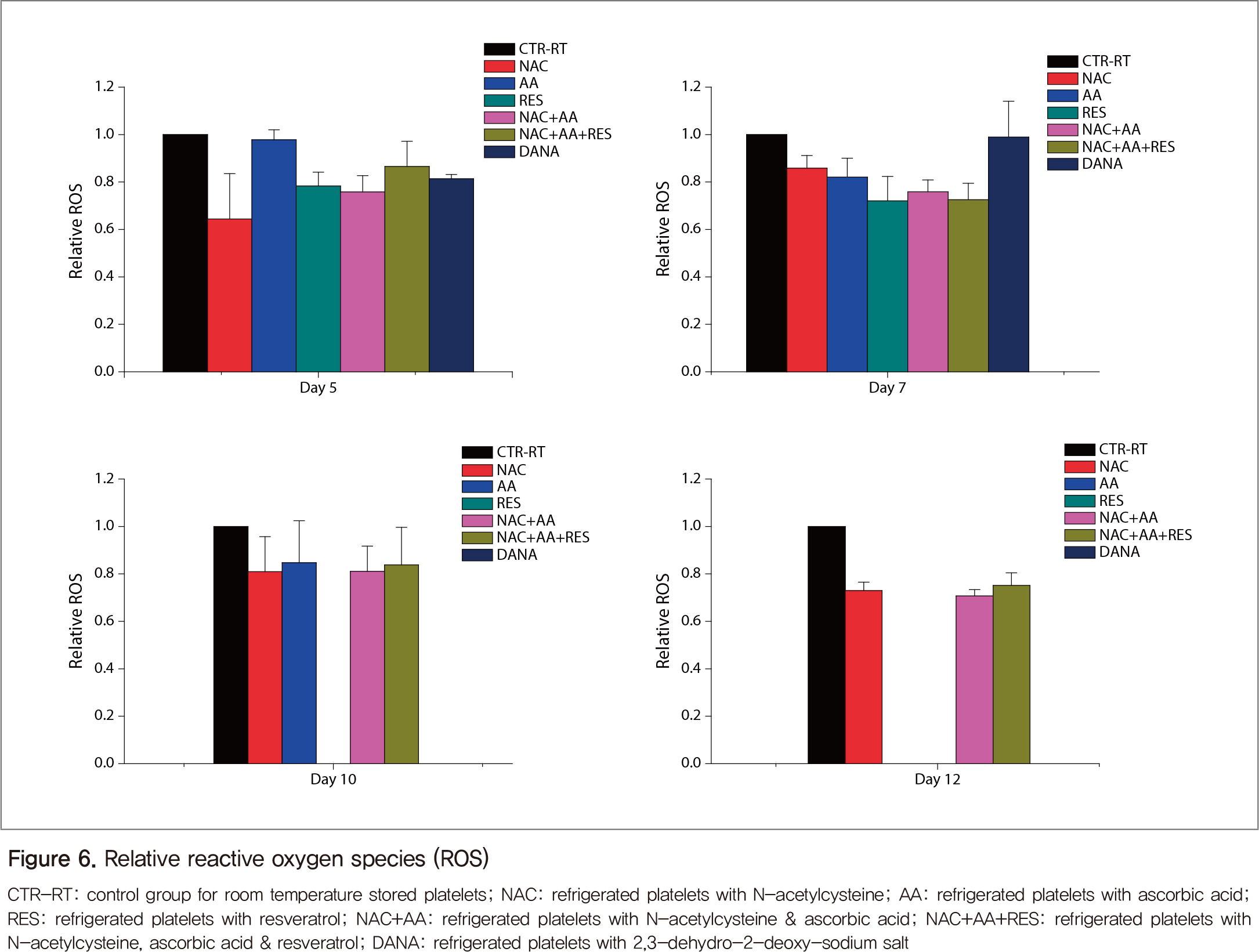
실온혈소판(대조군)의 ROS는 보관일수에 따라 증가하는데, 이를 1.0으로 보정하여 항산화제 처리 결과를 상대적으로 보았다(Figure 6). 보관일수에 따라 결과는 변동하였으나 항산화제 처리 혈소판의 ROS가 대체로 낮았으며, 5일째에서 NAC 처리 혈소판의 ROS가 가장 낮았으나 12일째는 비슷하였다.
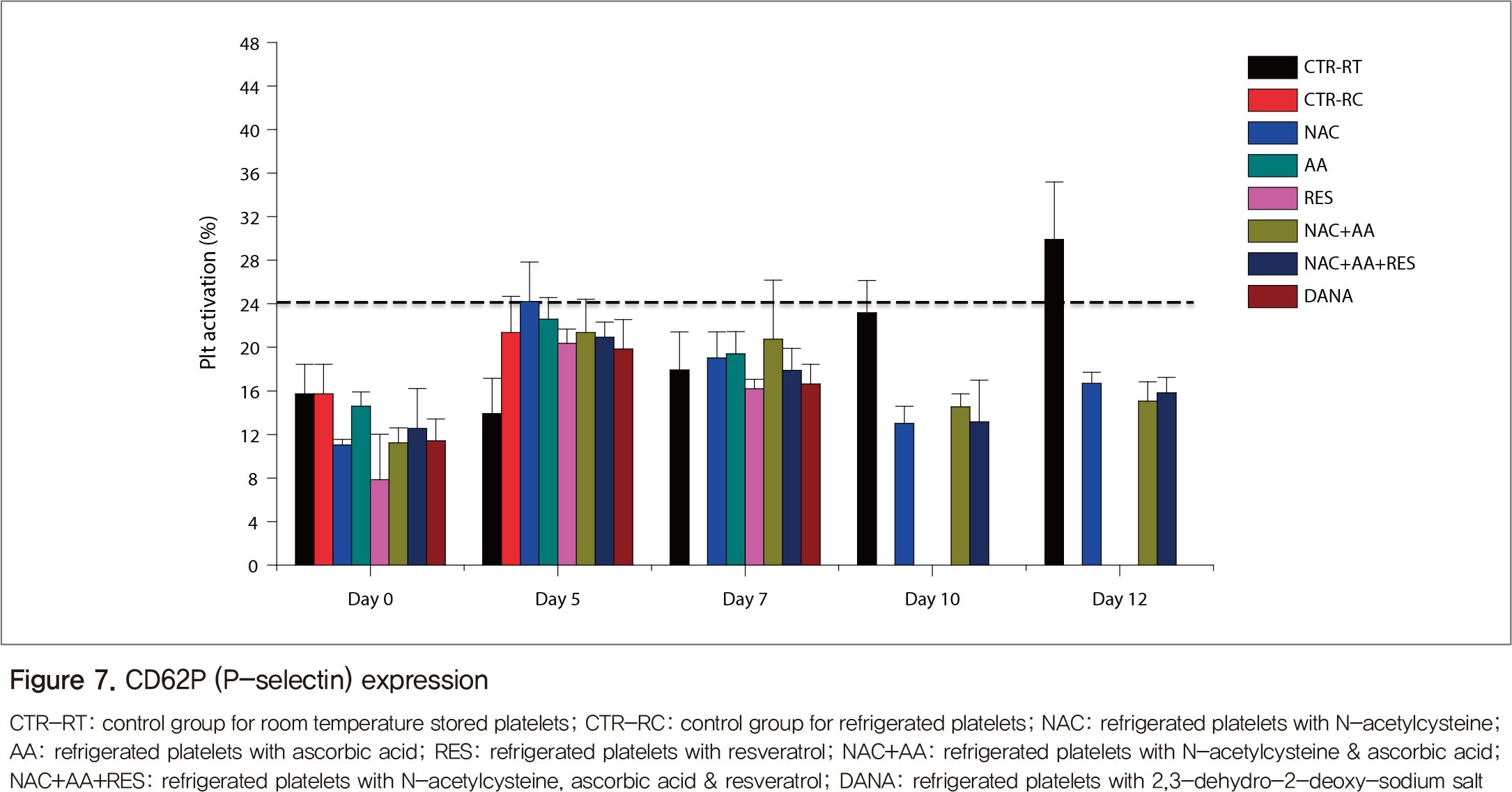
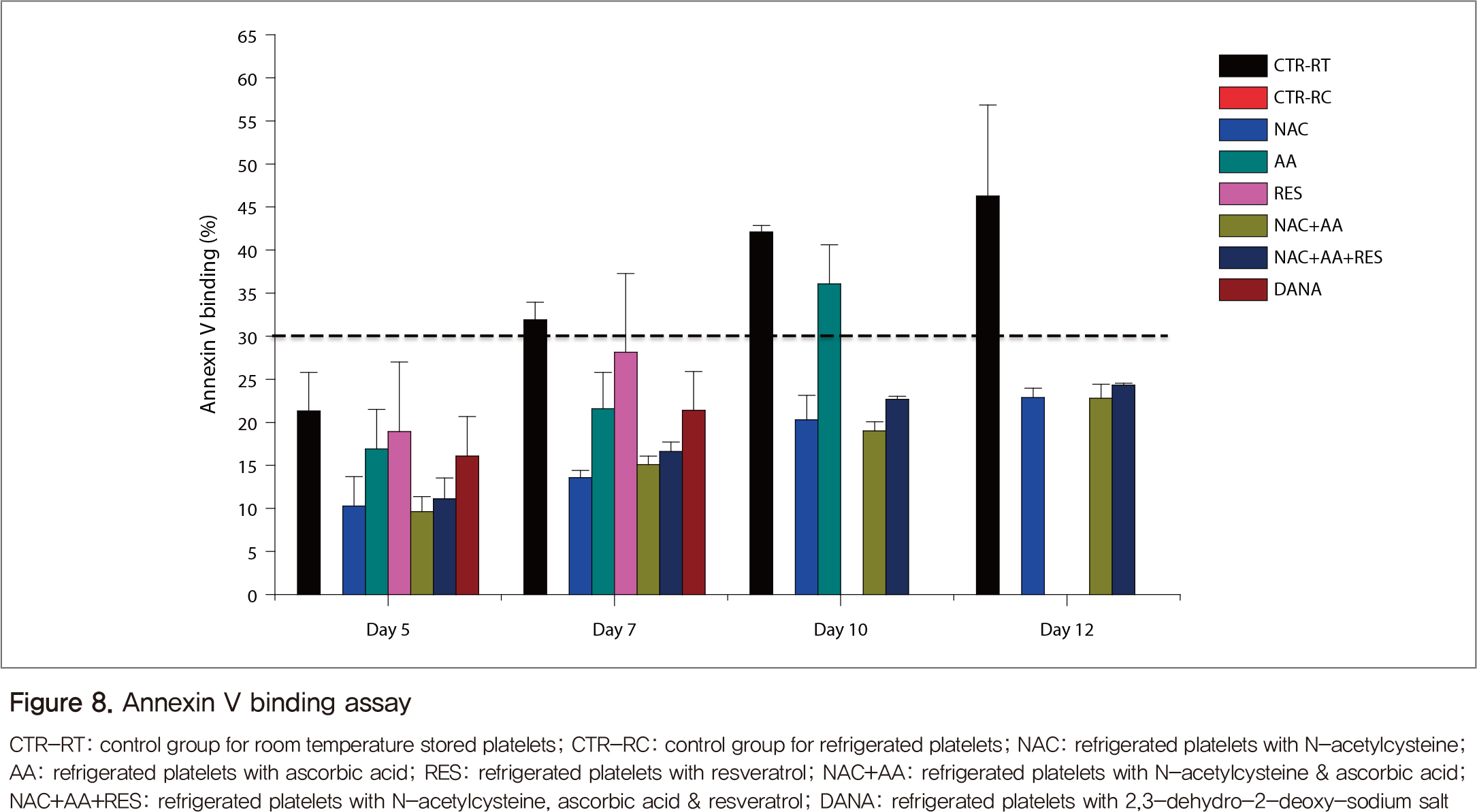
혈소판 활성화 분석 결과, CD62P(P-selectin) 발현은 실온혈소판에서 보관 5일까지는 비슷한 수준이었고, 7일 이후에는 12일까지 계속 증가하였다(Figure 7). 냉장혈소판은 5일째 실온 대조군에 비해 증가하였지만, 그 이후에는 혈소판 자체가 덩어리로 응집되어 결과를 얻을 수 없었다. 항산화제(NAC, AA, RES)를 첨가하면 5일째의 냉장혈소판 활성화는 억제하지 못하였지만, 7일째에는 실온 대조군과 비슷한 수준으로 유지하고 그 이후는 상대적으로 냉장혈소판의 활성화를 억제하는 것으로 나타났다. 실온혈소판의 Annexin V(AnV) 결합 정도 또한 CD62P와 비슷하게 보관일수에 따라 증가하였다(Figure 8). 냉장혈소판의 AnV 결과는 항산화제를 처리한 혈소판에서 실온혈소판에 비해 낮게 나타났는데, NAC가 보관일수와 무관하게 가장 안정적으로 AnV 결합을 억제하였다.
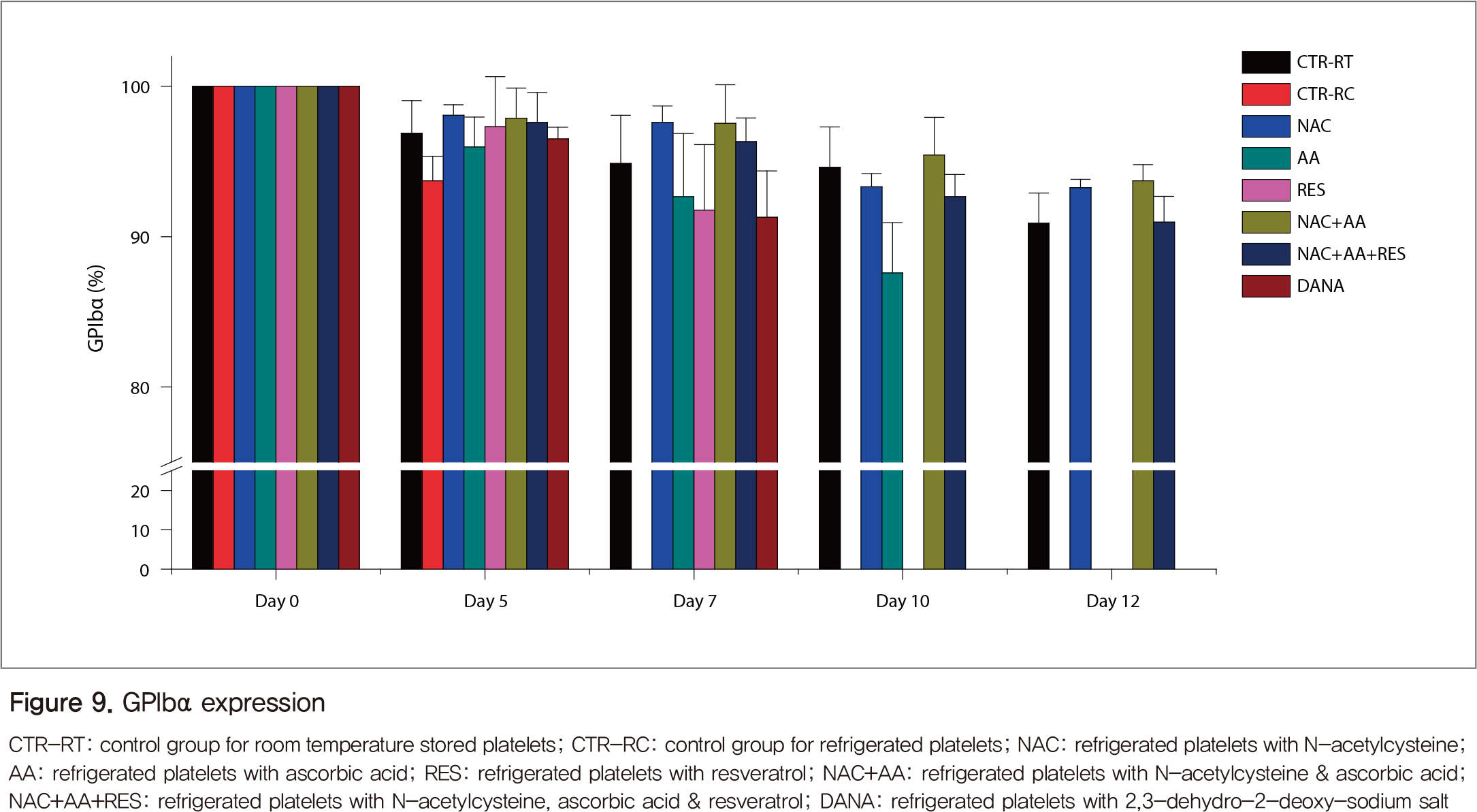
실온혈소판(대조군)의 GPIbα는 보관일수가 5일에서 12일로 증가함에 따라 감소하였고, 냉장혈소판은 5일째에 이미 대조군보다 유의하게 감소하였다(Figure 9). NAC 처리 냉장혈소판은 7일까지 실온대조군보다 유의하게 GPIba의 소실을 억제하였고, 10일 이후에는 변동을 보여 비슷하거나 좋은 결과를 보였다.
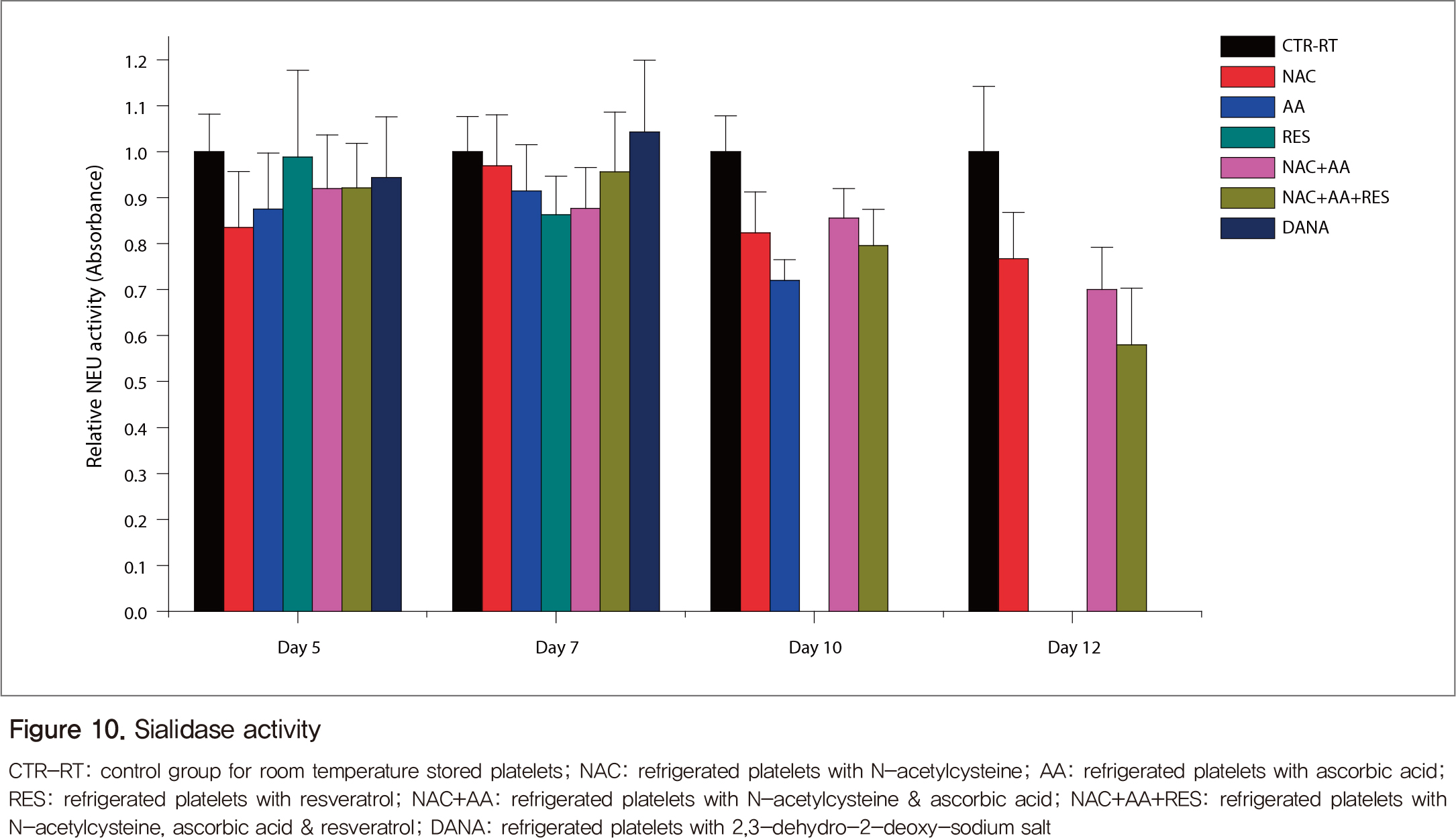
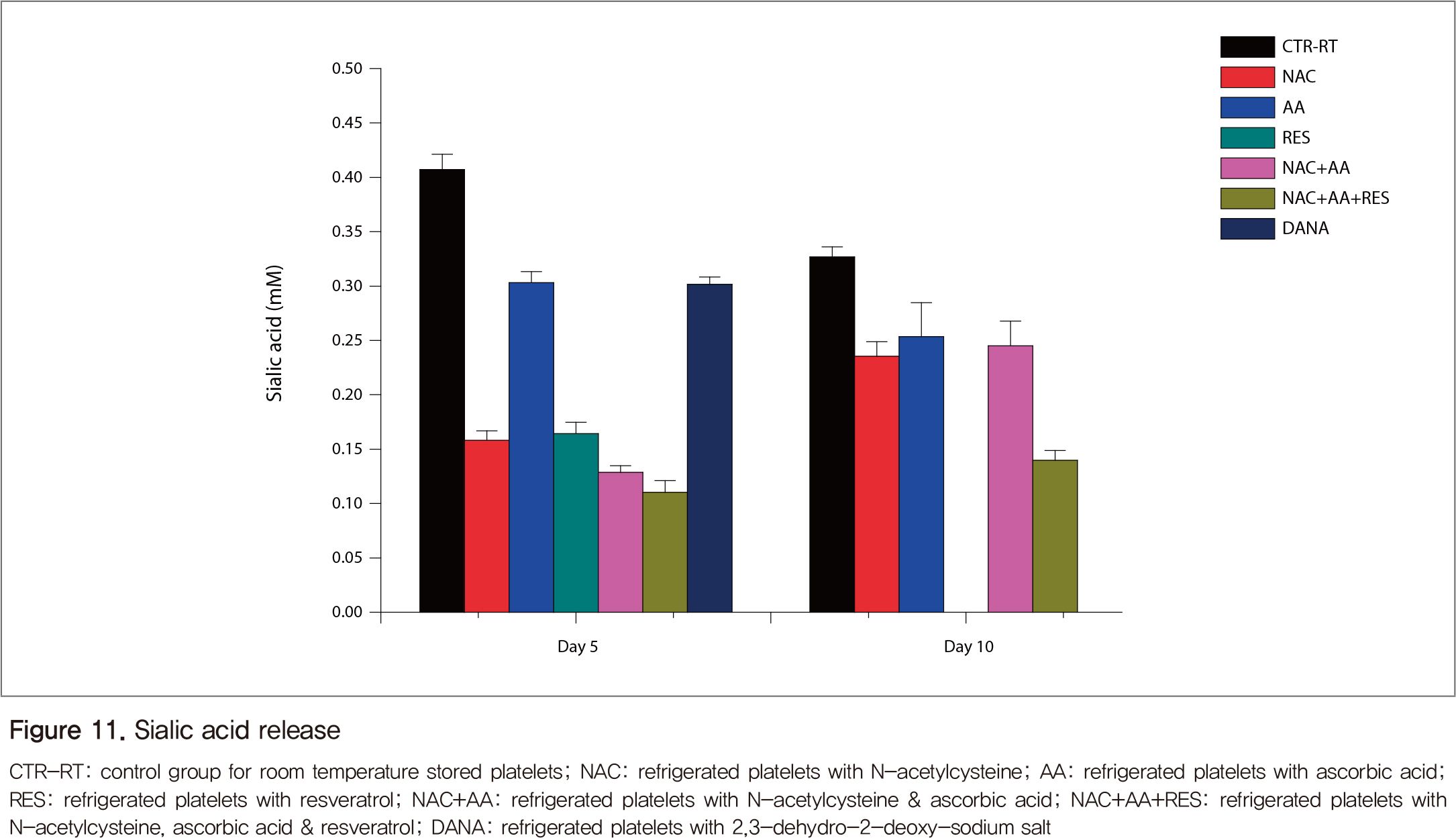
실온대조군의 sialidase 활성은 보관일수에 따라 큰 차이를 보이지 않았고, 항산화제에 의해 억제되었다(Figure 10). 단일 항산화제보다는 복합 항산화제를 처리한 조건에서 보관일수가 길어질수록 억제효과가 커졌다. 항산화제 처리 조건에서 혈소판 보존액의 sialic acid 양이 5일째와 10일째 모두 실온혈소판(대조군)에 비해 낮았다(Figure 11). 5일째의 경우 NAC와 RES가 AA에 비해 sialic acid의 release를 감소시켰고, 10일째에는 대조군에 비해 개개의 항산화제가 이를 감소시키는 정도는 큰 차이가 없으나 복합 항산화제(NAC+AA+RES)에 의해서는 더욱 감소하였다.
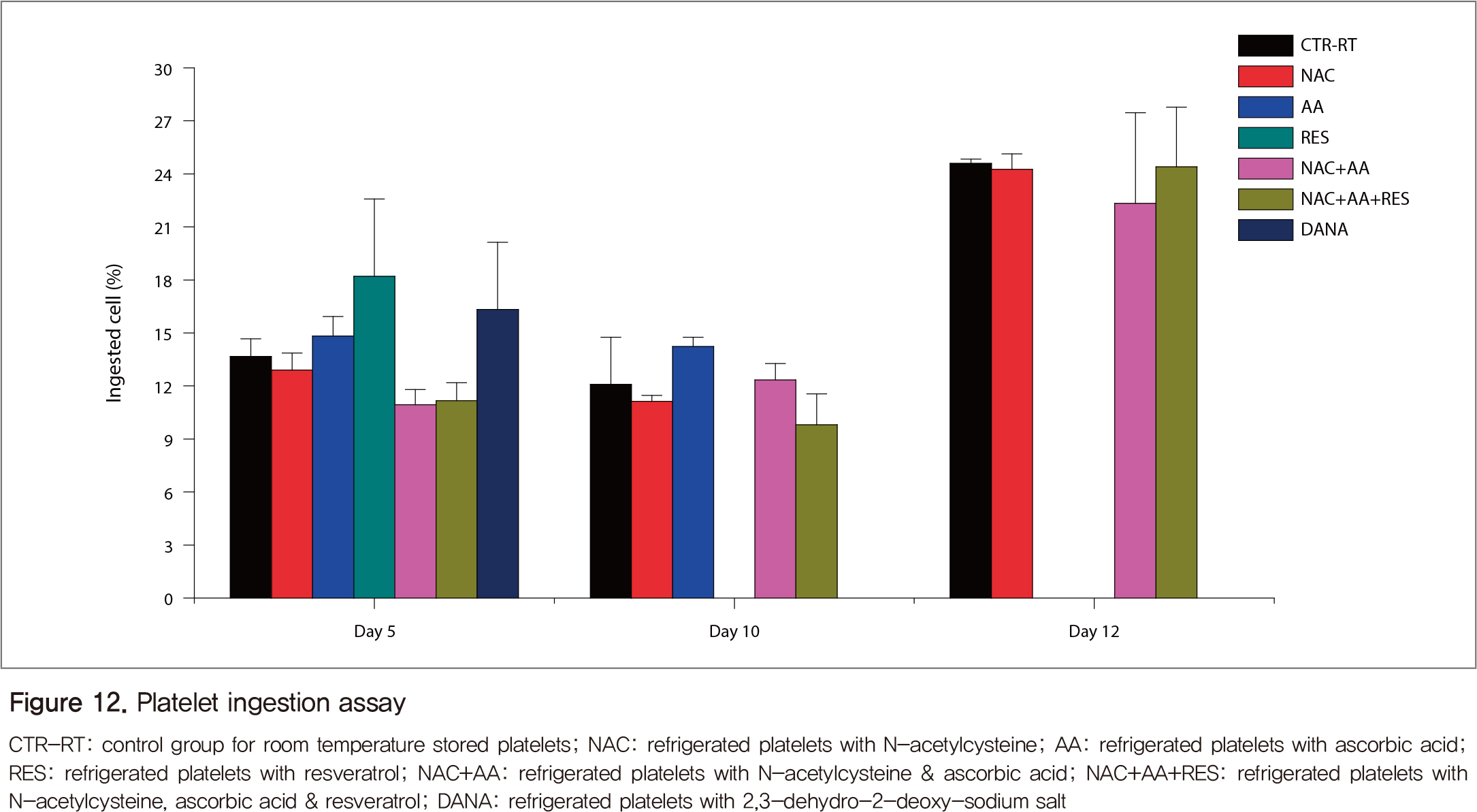
막표면의 sialic acid와 galactose가 제거된 활성화된 혈소판들이 간세포에 의해 얼마나 사라지는지 확인한 결과, 5일과 10일의 실온혈소판(대조군)은 HepG2세포에 의해 탐식되는 정도가 비슷하였으나 12일째는 크게 증가하였다(Figure 12). 항산화제 처리 냉장혈소판은 실온혈소판에 비해 탐식되는 정도가 비슷하거나 억제되었고, 보관일수가 길어질수록 실온혈소판(대조군)과 비슷하게 되었다. 항산화제 중에서는 NAC가 가장 안정적으로 HepG2 세포의 탐식을 억제하였다.
생체 내 분석 결과, 5일째 NAC 처리 냉장혈소판은 대조군보다 더 높은 혈소판 회수율을 보였고 AA처리 혈소판은 약간 감소하였으며 RES 처리는 항산화제 중에서 가장 낮았으나, 모두 기준선(cutoff) 이상을 유지하였다(data not shown). 10일째의 항산화제 처리 냉장혈소판은 모두 대조군보다 높은 회수율을 보였고, NAC가 가장 우수한 결과를 나타내었다.
맺는 말
본 연구에서는 냉장혈소판의 장기보존 가능성을 제시하였다. 항산화물질에 의한 sialidase 활성 억제효과와 in vivo recovery가 대조군에 비해 더 높은 결과를 보여, 약 2주까지의 기간에서도 항산화제 처리 냉장혈소판이 임상적으로 유효성을 가질 것으로 생각한다.
냉장혈소판의 유효성은 급성 출혈환자에서는 보관 3일 이내의 혈소판 기능보다는 못하지만, 예방적 혈소판 수혈이 필요한 혈소판 저하증 환자에서는 수혈 후 생체 내 회수율이나 생존능을 중요한 요소로 고려하여야 한다. 냉장혈소판의 수혈 후 제거기전으로 보관 과정에서 혈소판 표면에 있는 von Willebrand Factor 수용체의 구성요소인 당단백(GPIbα)의 clustering이 일어나고 그 말단에 위치하는 sialic acid가 제거되어, 단기(48시간 이내)로 냉장 보관된 경우에는 macrophage의 αMβ2 수용체에 의해 인지되어 phagocytosis를 거쳐 신속하게 제거되고 장기(48시간이상) 보관된 경우는 hepatocyte의 Ashwell-Morell Receptor에 의해 주로 제거된다.
본 연구에서도 60%정도의 냉장보존 혈소판이 수혈 후 신속하게 제거됨을 알 수 있었다. 냉장보존 혈소판이 세균성장을 억제하는 장점이 있지만, 수혈 후 제거되는 면역기전을 극복하지 못하면 임상적 유효성이 적을 것으로 생각하여 실온보존 혈소판의 수혈 후 제거를 기준(%)으로 냉장혈소판이 덜 제거되는 보호물질을 추가함으로 그 유효성을 확보할 수 있는지 살펴보았다. N-acetylcyteine 등 항산화제를 첨가하여 냉장 보존한 혈소판제제가 보관 12일에서도 개선된 생체 내 회수율을 확인하였다.
냉장혈소판제제의 국내 도입을 위해서는 기존의 생물학적 제제와 같이 임상적 유효성과 안전성 확보가 우선적으로 이루어져야하며 이를 위한 동물모델 및 인체대상의 광범위 임상시험 등 추가 연구가 필요하며, 냉장혈소판의 활성화 및 제거 기전을 차단하는 여러 물질에 대한 유효성을 확인하는 시스템이 확립되어야 한다. 본 연구결과는 이를 위한 기초자료로 활용 가능하며, 실제 국내도입 요건을 갖추기 위해서는 국내 관리기준의 통과와 혈액공급체계 등을 통한 혈액관리법의 품목허가가 이루어져야 한다. 다만 국내에서 냉장혈소판 관련 연구나 개발 시도가 매우 미미하기 때문에, 관련 학회나 임상의사 등 전문가 자문이나 연구 사업단을 아우르는 노력이 필요할 것이다. 향후 2주이상의 유효기간을 가지는 혈소판이 개발된다면, 냉장 보관하는 적혈구와 같은 수준의 혈소판 공급이 가능할 것으로 기대한다.
참고문헌
1. Handigund M, Bae TW, Lee J, Cho YG. Evaluation of in vitro storage characteristics of cold stored platelet concentrates with N-acetylcysteine (NAC). Transfus Apher Sci 2016;54:127-138.
2. Hoffmeister KM, Felbinger TW, Falet H, Denis CV, Bergmeier W, Mayadas TN, et al. The clearance mechanism of chilled blood platelets. Cell 2003;112:87-97.
3. Jansen AJ, Josefsson EC, Rumjantseva V, Liu QP, Falet H, Bergmeier W, et al. Desialylation accelerates platelet clearance after refrigeration and initiates GPIbalpha metalloproteinase-mediated cleavage in mice. Blood 2012;119:1263-1273.
4. Raghavan SA, Sharma P, Dikshit M. Role of ascorbic acid in the modulation of inhibition of platelet aggregation by polymorphonuclear leukocytes. Thromb Res 2003;110:117-126.
5. Sorensen AL, Rumjantseva V, Nayeb-Hashemi S, Clausen H, Hartwig JH, Wandall HH, et al. Role of sialic acid for platelet life span: exposure of beta-galactose results in the rapid clearance of platelets from the circulation by asialoglycoprotein receptor-expressing liver macrophages and hepatocytes. Blood 2009;114:1645-1654.
6. Vetlesen A, Mirlashari MR, Ezligini F, Kjeldsen-Kragh J. Evaluation of platelet activation and cytokine release during storage of platelet concentrates processed from buffy coats either manually or by the automated OrbiSac system. Transfusion 2007;47:126-132.
 본 공공저작물은 공공누리 "출처표시+상업적이용금지+변경금지" 조건에 따라 이용할 수 있습니다.
본 공공저작물은 공공누리 "출처표시+상업적이용금지+변경금지" 조건에 따라 이용할 수 있습니다.