contents area
주간건강과질병
detail content area
- 작성일2019-07-18
- 최종수정일2019-11-20
- 담당부서고위험병원체분석과
- 연락처043-719-8270
페스트 백신개발의 연구동향 및 전망
질병관리본부 감염병분석센터 고위험병원체분석과
최상윤, 전준호, 강병학, 이기은*
*교신저자 : gerhie@korea.kr, 043-719-8270
Abstract
Current development status and prospects of plague vaccines
Choi Sang-Yoon, Jeon Jun-Ho, Kang Byung Hak, Rhie Gi-eun
Division of High-risk Pathogens, Center for Laboratory Control of Infectious Diseases, KCDC
Yersinia pestis is a highly pathogenic Gram-negative, rod-shaped bacterium that causes plague. Y. pestis is classified as a high-risk pathogen, because of its severe threat to public health and safety. Currently, there is no safe and efficient vaccines to prevent plague. In the past, killed whole cell (KWC)- or live whole cell (LWC)-based vaccines had been developed to prevent plague. These types of vaccines were able to induce a strong immune response. However, these vaccines are associated with several adverse effects and are inefficient in providing long-term protection. Subunit vaccines reduce the risk factors and adverse effects associated with LWC and KWC vaccines. The capsular protein fraction 1/low-calcium response V (F1/LcrV)-based subunit vaccine failed to provide protection in the African green monkey model, although it provided protection in mice and cynomolgus macaques. Recently, several groups are attempting to enhance the immunogenicity of subunit vaccines. In this report, we introduce the latest research trends and prospects of plague vaccines.
Keywords: Yersinia pestis, Plague vaccine, Plague, Vaccine, F1/LcrV
들어가는 말
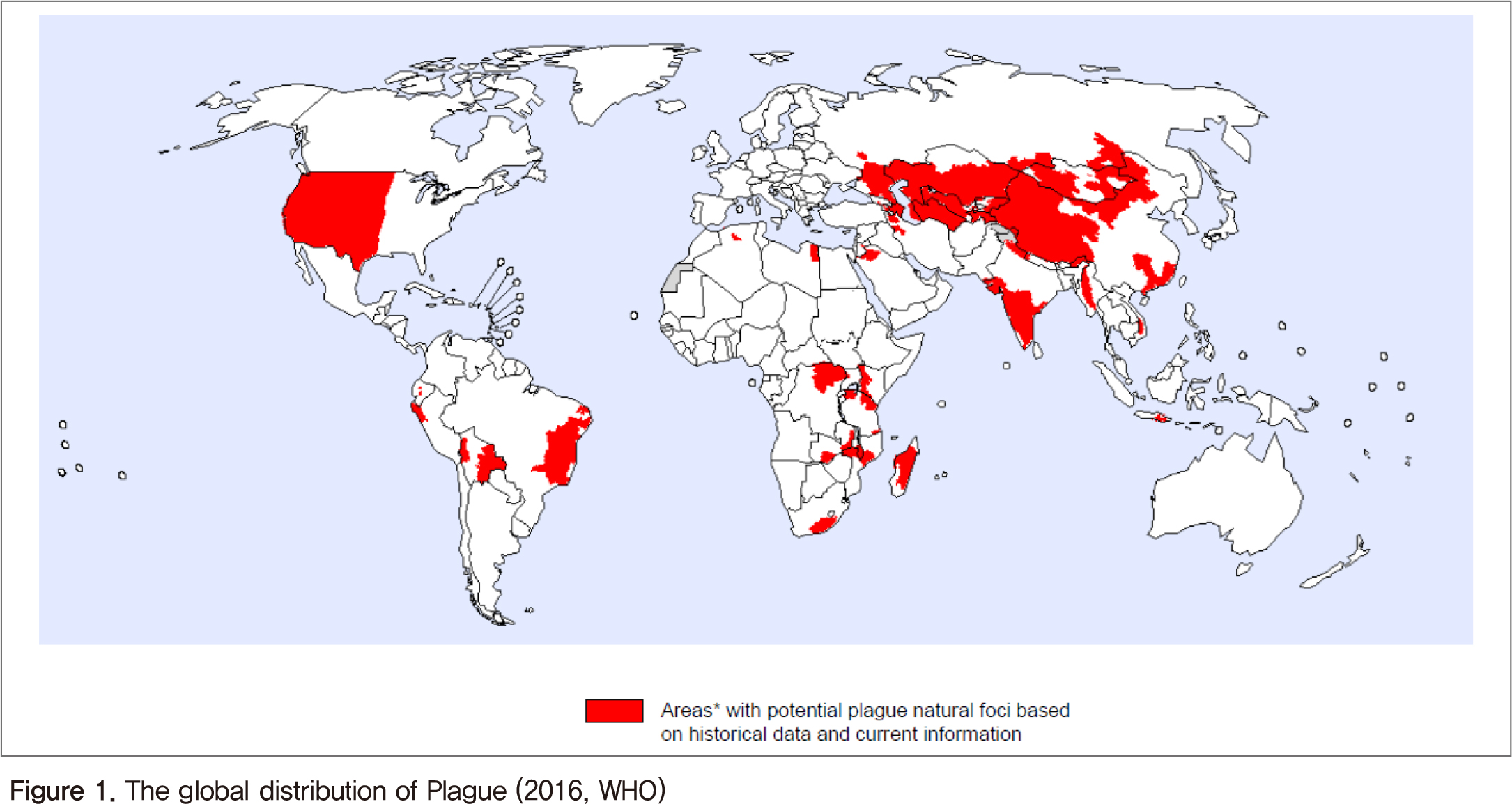
페스트(Plague)는 그람음성 간균인 페스트균(Yersinia pestis)의 감염에 의해 유발되는 전신성 질환으로 피부의 혈소 침전으로 인하여 검게 변하는 증상 때문에 흑사병(Black Death)으로 잘 알려져 있다. 페스트균은 주로 야생 설치류에게 감염되는 질환으로 설치류 사이에 전파되다가 벼룩에 의해 사람에게 전염이 이루어진다. 지금도 페스트는 전 세계적으로 아프리카와 아시아, 그리고 남미 등을 중심으로 매년 2,000여 건의 발생사례가 세계보건기구(World Health Organization, WHO)에 보고되고 있다(Figure 1). 세계보건기구는 세계적으로 사람에서의 감염사례가 증가함에 따라 페스트를 재출현감염병으로 분류하였다[1].
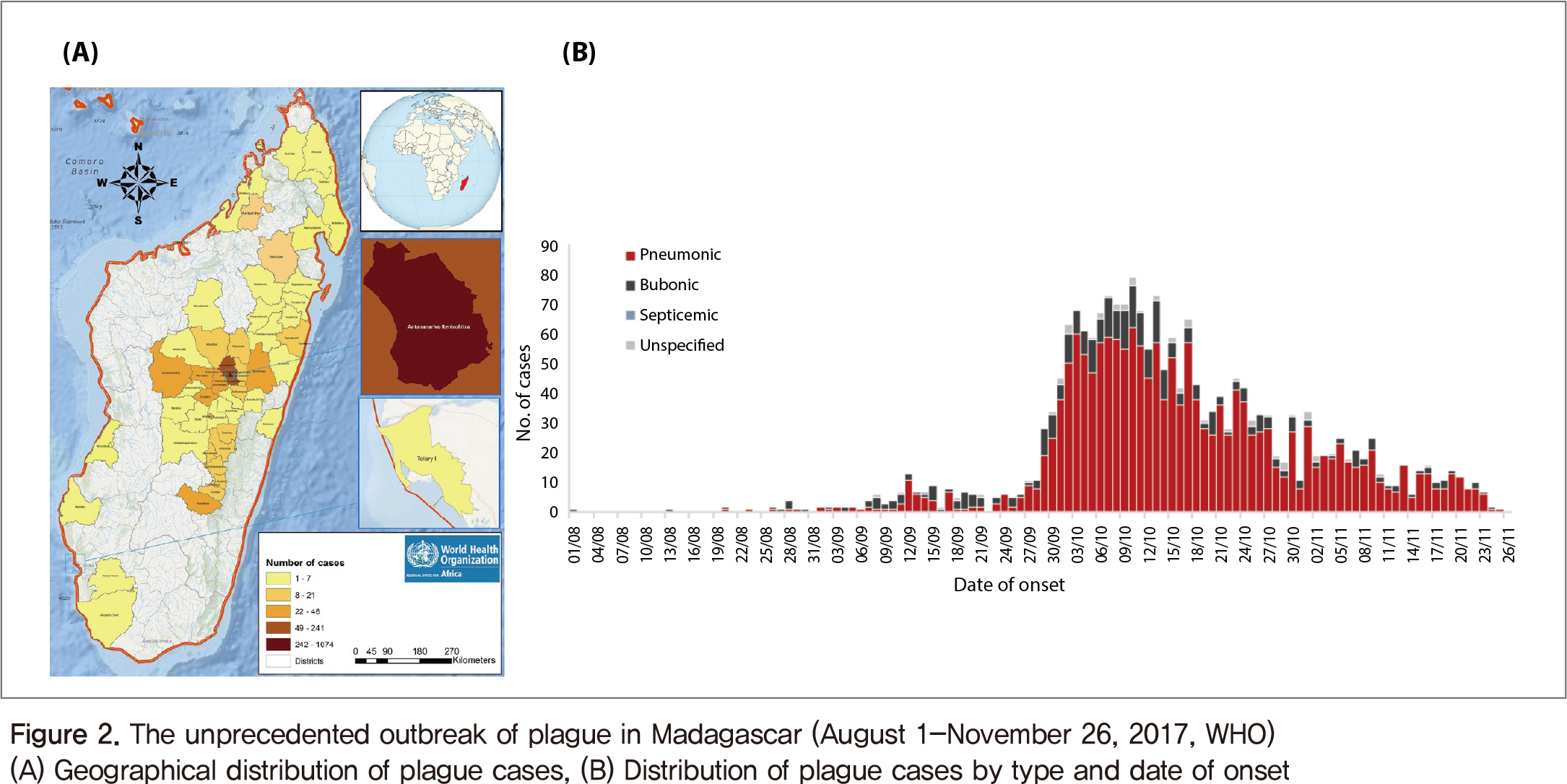
세계보건기구는 2017년 8월에서 11월까지 마다가스카르에서 발생한 페스트 유행으로 2,417명의 환자가 발생하였으며 209명의 사망자(사망률 8.6%)가 나타난 감염병 사례를 보고하였다(Figure 2). 보고된 사례의 대다수가 폐 페스트(Pneumonic plague) (1,828명, 75.6%)로 비말 전파가 가능하며 수도 및 항구도시에서 발생하고 있어 국가 간의 전파가능성이 높을 것으로 예상되어 엄격한 대응, 통제 및 지속적인 감시활동을 지원하고 있다[2,3].
페스트는 현재까지 국내에서의 발생보고는 없으나, 해외여행객의 증가 및 페스트 발생지역으로부터 내국인과 외국인 입국자의 증가로 인해 페스트의 국내 유입가능성이 증대되고 있다[4]. 또한, 페스트균이 생물무기로 개발될 가능성이 높다는 것을 고려할 때 국가 안보 강화, 생물테러 발생 시 효과적으로 대응할 수 있는 페스트 백신 개발을 위한 기초자료로 활용하고자 한다[5].
몸 말
1. KWC(Killed Whole Cell) 및 LWC(Live Whole Cell) 기반 페스트 백신
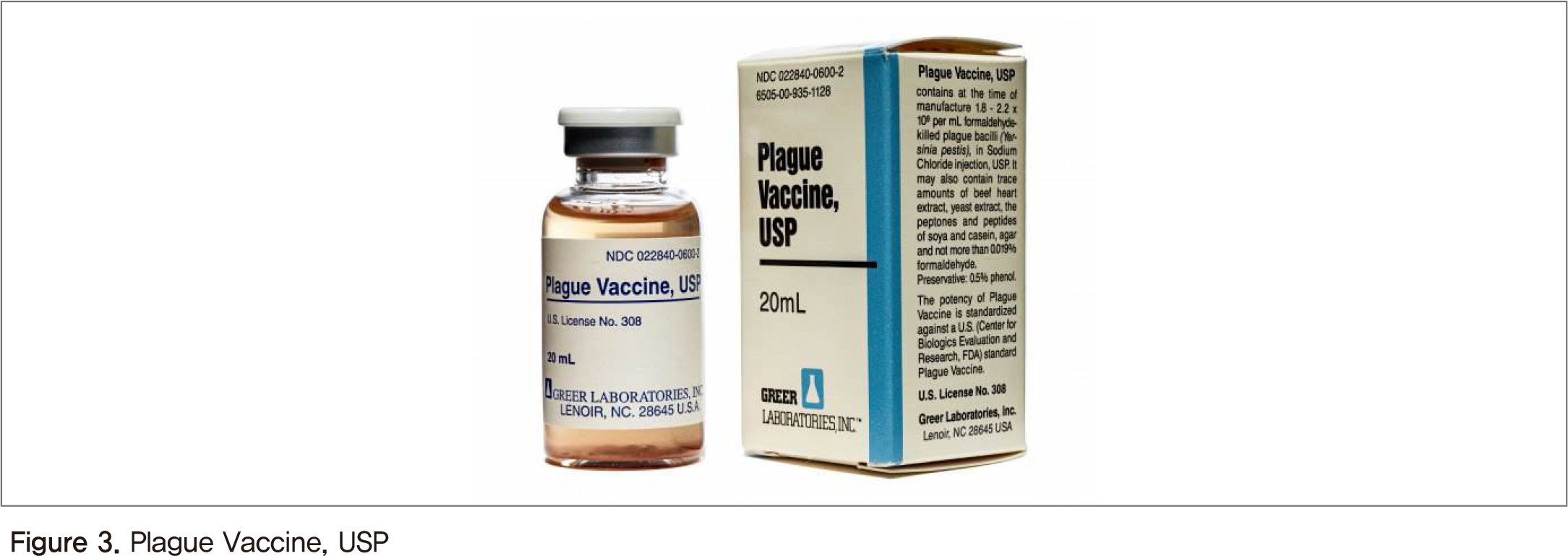
페스트균은 1894년 프랑스 과학자 Alexandre Yersin에 의해 처음으로 발견되었으며, Yersin 실험실에서 정상 페스트균, 페스트 사균 및 여러 계대 배양을 통해 병원성을 잃은 약독화 페스트균을 사용하여 토끼, 쥐 등 소동물에 면역한 실험이 백신 개발의 시초가 되었다[6]. 이러한 연구결과를 토대로 KWC 또는 LWC 기반의 백신개발이 촉진되었다. 열처리 또는 화학물질을 통해 비활성화된 KWC 백신은 림프절 페스트(Bubonic plague)모델에서 안전성과 면역 능력이 확인되었지만, 폐 페스트 모델에서는 효과가 없었다[7]. 미국 식품의약품안전청(Food and Drug Administration, FDA)에서 최초로 승인을 받은 페스트 백신은 Plague Vaccine, USP(Cutter Biological사 제조, 1940-1999)로 Yersinia pestis 195/P를 포르말린을 이용해 사멸하여 사용한 대표적인 KWC 백신이다(Figure 3). 이 백신은 림프절 페스트를 방어하는데 효과적이지만 부작용을 유발할 뿐만 아니라 추가로 백신을 접종해야 하는 불편함이 있으며, 폐 페스트에 대한 예방을 할 수 없어 1999년에 생산이 중단되었다.
LWC 백신은 KWC에 비해 림프절 페스트와 폐 페스트에 대해 높은 방어효과를 보였으나 영장류 모델에서 부작용이 확인되었다[8]. 대표적인 LWC 백신은 High-Pathogenic Island(HPI)와 색소(Pigmentation) 관련 유전자가 결여된 EV76 균주로써 옛 소련 위성 국가와 중국 등을 중심으로 림프절 페스트와 폐 페스트의 예방을 위하여 사용되었다. 그러나 심한 통증, 두통, 식욕부진, 발열 등의 부작용이 나타남으로써 현재 일부 국가만이 사용하고 있다. 최근에는 페스트균의 다양한 병독력인자를 결손 시킨 균주를 이용한 약독화된 페스트 LWC 에 대한 연구가 진행 중이다[9].
2. 단백질(Subunit) 기반 페스트 백신
현재 페스트 주요 항원인 capsular subunit protein F1과 low-calcium response V 항원(LcrV)을 이용한 단백질 백신 연구가 활발히 진행되고 있다. F1과 V 단백질을 단독으로 이용한 백신은 페스트균 감염 마우스모델에서 높은 방어효과를 보이지 못하였지만, 재조합 F1/V 결합단백질 백신은 F1과 V 단백질을 단독으로 이용한 백신에 비해 폐 페스트와 림프절 페스트에 대한 방어 효과가 높았으며, 마우스 모델과 다양한 동물 모델에서도 방어효과를 보였다. 대표적인 예로 미육군 감염병 의학연구소(United States Army Medical Research Institute for Infectious Disease; USAMRIID)에서 개발한 재조합 2가 F1/V 결합단백질을 이용한 백신은 마우스와 영장류의 폐 페스트 모델에서 방어효과를 보였으나 African green monkey를 이용한 폐 페스트 모델에서는 완벽한 방어효과를 보이지는 못하였다[10]. 현재 재조합 F1/V 결합 단백질 백신은 FDA승인을 위해 임상 2상 연구를 진행 중으로 알려져 있다. 최근 연구에서는 박테리오파지 T4 나노입자가 표지된 F1mut-V 결합단백질 백신은 보조제 없이도 마우스 모델에서 폐 페스트에 대한 완벽한 방어 효과를 보이는 것으로 보고되었다[11].
3. 기타 페스트 백신
F1과 LcrV 항원 기반 DNA 백신은 낮은 면역원성을 보였으나 면역 증강제인 IL-12와 tissue plaminogen activator(tPA) 단백질 결합을 통해 체액성 면역반응을 유도함으로써 폐 페스트에 방어효과를 나타내었다[12,13]. 그러나 DNA 기반 백신은 함께 발현되는 면역 증강제에 크게 의존하고 있어 미래의 사람에게 백신으로 사용되기 위해서는 최적화가 필요하다.
바이러스 기반 백신은 바이러스 벡터를 활용하여 대식세포의 활성화를 통해 체액성 및 세포성 면역을 유도하는 방식이다. Crystal 그룹에서는 페스트 V 항원을 아데노바이러스 벡터에 삽입한 재조합 바이러스를 개발하였다[14]. 재조합 바이러스는 체액성 및 세포성 면역을 유도하여 폐 페스트에 대한 방어 효과를 보였다. 최근에는 5형 아데노바이러스(Ad5)를 사용하여 1가(rAd5-LcrV) 및 3가(rAd5-YFV) 백신을 개발하였으며, 3가 백신은 마우스 모델에서 림프절 페스트와 페 페스트에서 뛰어난 방어 효과를 보였을 뿐만 아니라 영장류(Cynomolgus Macaques) 모델에서도 완벽한 방어효과를 보였다[15]. 이 밖에도 Stomatitis Virus 및 Vaccinia Virus 벡터를 이용한 페스트 백신개발 연구가 진행 중이다[16,17].
4. 페스트 백신의 미래전망
기존 KWC 백신과 약독화된 LWC 백신은 안정성의 우려가 높기 때문에 단백질 기반 또는 DNA 백신, 여러 가지 방법을 활용한 백신 개발이 필요하다. 앞으로 높은 가능성이 있는 F1/LcrV 기반 subunit 백신은 주로 체액성 면역을 유도하여 동물 모델에서 매우 뛰어난 효과를 보이지만 사람에게서의 방어효과는 아직 확인되지 않았다. 또한 F1/LcrV 기반 subunit 백신은 정기적으로 추가 접종해야하는 단점이 있다. 이에 차세대 페스트 백신은 단점을 보완할 수 있는 체액성 면역뿐만 아니라 세포성 면역이 동반하도록 개발되어야 하며 이에 대한 연구가 필요할 것으로 사료된다.
맺는 말
페스트는 페스트균에 의해 야기되는 전염병으로 역사적으로 2억 명이 넘는 사망자를 발생시킨 무서운 질병이며[18], WHO에 보고된 바에 따르면 현재 전 세계적으로 2,000~5,000명의 환자가 매년 발생되고 있다. 미국 질병관리본부(Centers for Disease Control and Prevention, CDC)에서는 페스트균을 Tier 1 Select Agents and Toxins으로 지정하여 엄격히 관리하고 있다. 항생제 치료기술의 향상으로 페스트 위협이 많이 줄어들었으나 최근 몽골 및 마다가스카르에서는 다재내성 페스트균이 발견되었다[19,20]. 따라서 기존 항생제 치료법 이외에 다른 치료제나 예방법이 개발되어야 할 필요가 있다. 현재 미국 식품의약품안전청에서 승인된 백신은 없으므로 페스트를 이용한 생물테러나 자연발생에 효과적으로 대비하기 위해서는 새로운 백신 개발의 지속적인 투자와 연구를 통해 공중보건 위기 대응을 강화해 나가야 할 것으로 사료된다.
참고문헌
1. Bertherat, E. G. Plague around the world, 2010?2015. Wkly. Epidemiol. Rec. 2015;91:89-104.
2. https://reliefweb.int/report/madagascar/madagascar-plague-outbreak-external-situation-report-14-4- december-2017
3. http://www.who.int/mediacentre/news/releases/2018/end-plague-madagascar/en/
4. 법무부. “출입국외국인정책통계연보”. 2017. pp.1-100.
5. 남만권. “북한 화생무기 위협 평가 및 대응방향 연구.” 군사학연구Ⅵ. 2008. pp.189-218.
6. Girard G. Immunity in plague infection: results of 30 years of work with the Pasteurella pestis EV strain (Girard and Robic). Biol Med (Paris). 1963;52:631.
7. Russell P, Eley SM, Hibbs SE, Manchee RJ, Stagg AJ, Titball RW. A com-parison of plague vaccine, USP and EV76 vaccine induced protection against Yersinia pestis in a murine model. Vaccine. 1995;13:1551-1556.
8. Meyer KF. Effectiveness of live or killed plague vaccines in man. Bull World Health Organ. 1970;42:653-666.
9. Feodorova VA, Corbel MJ. Prospects for new plague vaccines. Expert Rev Vaccines. 2009;8:1721-1738.
10. Heath DG, Anderson GW Jr, Mauro JM, Welkos SL, Andrews GP, Adamovicz J, et al. Protection against experimental bubonic and pneumonic plague by a recombinant capsular F1-V antigen fusion protein vaccine. Vaccine. 1998;16:1131-1137.
11. Tao P, Mahalingam M, Kirtley ML, van Lier CJ, Sha J, Yeager LA, et al. Mutated and bacteriophage T4 nanoparticle arrayed F1-V immunogens from Yersinia pestis as next generation plague vaccines. PLoS Pathog. 2013;9:e1003495.
12. Yamanaka H, Hoyt T, Yang X, Golden S, Bosio CM, Crist K, et al. A nasal interleukin-12 DNA vaccine co expressing Y. pestis F1-V fusion protein confers protection against pneumonic plague. Infect Immun. 2008;76:4564-4573.
13. Wang S, Heilman D, Liu F, Giehl T, Joshi S, Huang X, et al. A DNA vaccine producing LcrV antigen in oligomers is effective in protecting mice from lethal mucosal challenge of plague. Vaccine. 2004;22:3348-3357.
14. Chiuchiolo MJ, Boyer JL, Krause A, Senina S, Hackett NR, Crystal RG. Protective immunity against respiratory tract challenge with Yersinia pestis in mice immunized with an adenovirus-based vaccine vector expressing V antigen. J Infect Dis. 2006;194:1249-1257.
15. Sha J, Kirtley ML, Klages C, Erova TE, Telepnev M, Ponnusamy D, et al. A replication-defective human type 5 adenovirus-based trivalent vaccine confers complete protection against plague in mice and nonhuman primates. Clin Vaccine Immunol. 2016;7:586-600.
16. Palin A, Chattopadhyay A, Park S, Delmas G, Suresh R, Senina S, et al. An optimized vaccine vector based on recombinant vesicular stomatitis virus gives high-level, long-term protection against Yersinia pestis challenge. Vaccine. 2007;25:741-750.
17. Bhattacharya D, Mecsas J, Hu LT. Development of a vaccinia virus based reservoir-targeted vaccine against Yersinia pestis. Vaccine. 2010;28:7683-7689.
18. Perry RD, Fetherston JD. Yersinia pestis?etiologic agent of plague. Clin Microbiol Rev. 1997;10:35-66.
19. Kiefer D, Dalantai G, Damdindorj T, Riehm JM, Tomaso H, Zoller L, et al. Phenotypical characterization of Mongolian Yersinia pestis strains. Vector Borne Zoonotic Dis. 2012;12:183-188.
20. Galimand M., et al. Multidrug resistance in Yersinia pestis mediated by a transferble plasmid. N. Engl. J. Med. 1997;337:677-680.
 본 공공저작물은 공공누리 "출처표시+상업적이용금지+변경금지" 조건에 따라 이용할 수 있습니다.
본 공공저작물은 공공누리 "출처표시+상업적이용금지+변경금지" 조건에 따라 이용할 수 있습니다.