contents area
유전자변형생물체국가안전관리
- 작성일2020-09-22
- 최종검토일2024-02-01
- 담당부서생물안전평가과
- 연락처043-719-8046
detail content area
시험·연구용 유전자변형생물체
위해 가능성이 큰 유전자변형생물체를 수입하는 경우, 사전에 질병관리청장의 승인을 받아야 합니다.
수입 승인 대상범주
- 종명까지 명시되어 있지 아니하고 인체병원성 여부가 밝혀지지 아니한 미생물을 이용하여 얻어진 유전자변형생물체
- 척추동물에 대하여 몸무게 1kg당 50% 치사독소량이 100ng 미만인 단백성 독소를 생산할 능력을 가진 유전자변형생물체
: 보툴리눔독소(A, B, C, D, E, F형), 파상풍독소, 이질신경독소, 디프테리아독소 등 - 의도적으로 도입된 약제내성 유전자를 가진 유전자변형미생물
: 다만 아래의 경우 승인 제외 (별표 2-2에 해당하는 약제내성 유전자를 가진 유전자변형미생물) - Ampicillin, chloramphenicol, hygromycin, kanamycin, neomycin, puromycin, spectinomycin, streptomycin, tetracycline 또는 zeocin 내성유전자가 인정 숙주-벡터계를 이용하여 도입된 유전자변형미생물의 수입에 한함
- 별표 2-3으로 지정된 국민보건 상 국가관리가 필요한 병원성미생물의 유전자를 직접 이용하거나 해당 병원미생물의 합성된 유전자를 이용하여 얻어진 유전자변형생물체
- 국민보건 상 국가관리가 필요한 병원미생물 목록(LMO법 통합고시 별표 2-3) [바로가기]
- 상용․시판되는 유전자변형 동물 및 식물 세포주(cell-line) 수입은 질병관리청의 승인 대상이 아니므로 과학기술정보통신부에 수입신고 해야 합니다.
- 수입승인 받은 유전자변형생물체를 이용하여 유전자재조합 행위 없이 배양(증식)만 하는 경우도 실험에 해당하여 질병관리청에 개발∙실험 승인을 받아야 합니다.
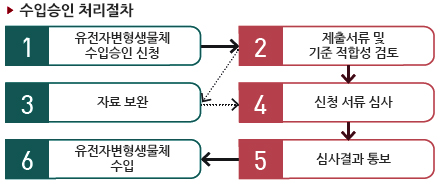
제출서류
- ① 시험·연구용 등의 유전자변형생물체 수입승인신청서 (별지 서식 15호)파일 다운로드
- ② 수입계약서 (수입대행계약서 포함) 또는 주문서 사본
- ③ 유전자변형생물체의 명칭·특성 및 용도에 관한 정보
- ④ 시험·연구용 (박람회·전시회용) 유전자변형생물체 운반계획서 또는 운반경로·수단·업자가 기록된 운반계약서
- ⑤ 시험·연구용(박람회·전시회용) 유전자변형생물체 안전관리계획서
※ 연구시설 신고확인서·허가서 첨부 - ⑥ 시험·연구용 유전자변형생물체 사용계획서
- ⑦ 정부 수입인지 - 행정 수수료용 발급 (2만원)
※ 단, 시행령 제31조에 따른 대학・산업대학・전문대학 및 기술대학, 정부출연연구기관, 국공립 연구기관, 한국보건산업진흥원, 「특정연구기관육성법」에 따른 특정연구기관은 면제
처리기한(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
- 60일 이내
- 기 승인된 유전자변형생물체와 동일한 유전자변형생물체를 재수입하는 경우: 10일 이내
보건의료용 유전자변형생물체 수입 승인
- 보건의료분야에 사용되는 유전자변형생물체 수입은 질병관리청의 승인을 받아야합니다.
제출 서류
- ① 유전자변형생물체 수입승인 신청서(별지서식5호)파일 다운로드
- ② 질병관리청가 발급한 위해성심사 승인결과서
- ③ 수입계약서(수입대행계약서 포함) 또는 주문서 사본
- ④ 유전자변형생물체 운반계획서 또는 운반경로·운반수단 및 운반업자가 기록된 운반계약서
- ⑤ 유전자변형생물체 안전관리계획서
※ 취급·보관 안전관리방안, 안전관리 인력 (취급자 및 관리책임자) 및 안전관리 설비 연구시설 신고확인서·허가서 등) 현황 등의 정보 기재 - ⑥ 유전자변형생물체 사용계획서
처리기한(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
- 10일 이내
전시회·박람회 사용을 위한 보건 의료용 유전자변형생물체 수입신고
- 전시회·박람회 출품 목적의 보건의료용 유전자변형생물체 수입 시 질병관리청에 신고해야 합니다.
제출서류
- ①시험·연구용 등의 유전자변형생물체 수입 신고서(시험·연구용, 박람회·전시회용)(별지 서식13호) 파일 다운로드
- ② 수입계약서(수입을 대행하는 경우에는 수입대행계약서를 포함) 또는 주문서 사본
- ③ 시험·연구용(박람회·전시회용) 유전자변형생물체 운반계획서 또는 운반경로·운반수단 및 운반업자가 기록된 운반계약서
- ④ 시험·연구용(박람회·전시회용) 유전자변형생물체 안전관리계획서
※ 취급·보관 안전관리방안, 안전관리 인력(취급자 및 관리책임자) 및 안전관리 설비(연구시설 신고확인서·허가서 등) 현황 등의 정보 기재 - ⑤ 시험·연구용(박람회·전시회용)유전자변형생물체 개요서
- ⑥ 박람회·전시회용 유전자변형생물체 출품계획서
- ⑦ 기타 증빙 자료
처리기한(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
- 30일 이내





