contents area
유전자변형생물체국가안전관리
- 작성일2025-03-19
- 최종검토일2025-06-18
- 담당부서생물안전평가과
- 연락처043-719-8046
detail content area
시험·연구용 유전자변형생물체 수입승인
위해 가능성이 큰 유전자변형생물체를 수입하는 경우, 질병관리청장의 사전 승인 필수
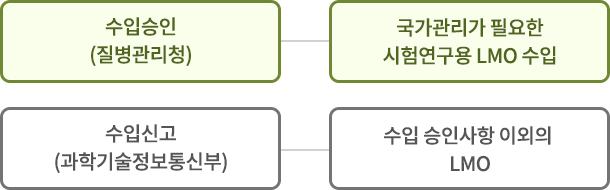
[시험·연구용 LMO 수입 관리]
- 질병관리청(수입 승인) - 국가관리가 필요한 시험연구용 LMO 수입
- 과학기술정보통신부(수입 신고) - 수입 승인사항 이외의 LMO
유전자변형생물체 수입승인 대상범주
- 상용․시판되는 유전자변형 동물 및 식물 세포주(cell-line) 수입은 과학기술정보통신부에 수입신고
- 수입승인 받은 유전자변형생물체를 이용하여 유전자재조합 행위 없이 배양(증식)만 하는 경우도 개발·실험 승인 필요
수입승인 처리절차
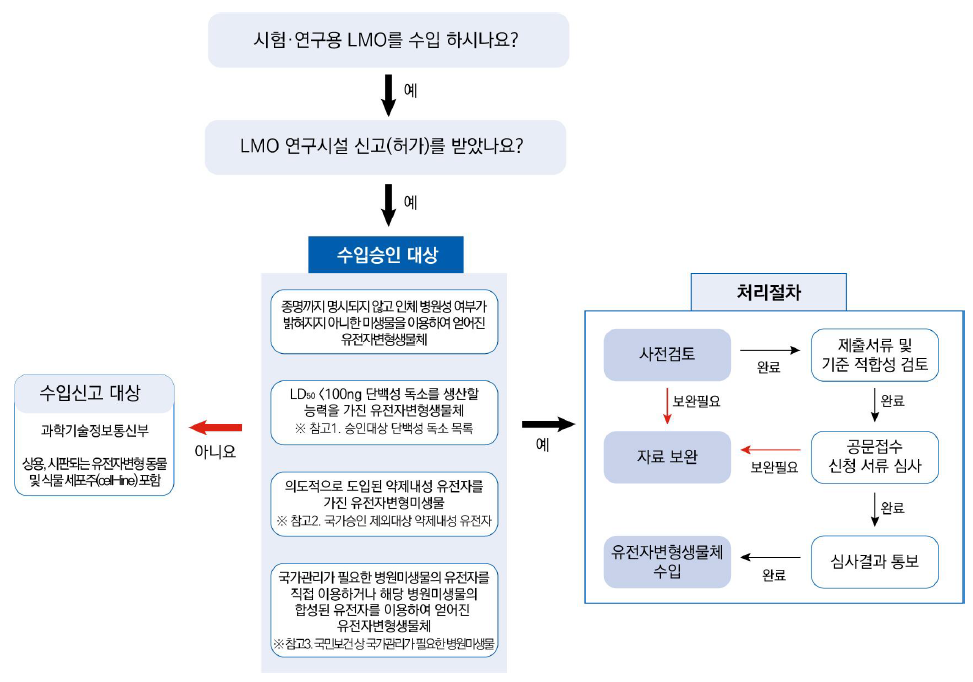
[LMO 수입승인 절차]
- 질병관리청(수입 승인) - 국가관리가 필요한 시험연구용 LMO 수입
- 과학기술정보통신부(수입 신고) - 수입 승인사항 이외의 LMO
수입승인 제출 서류
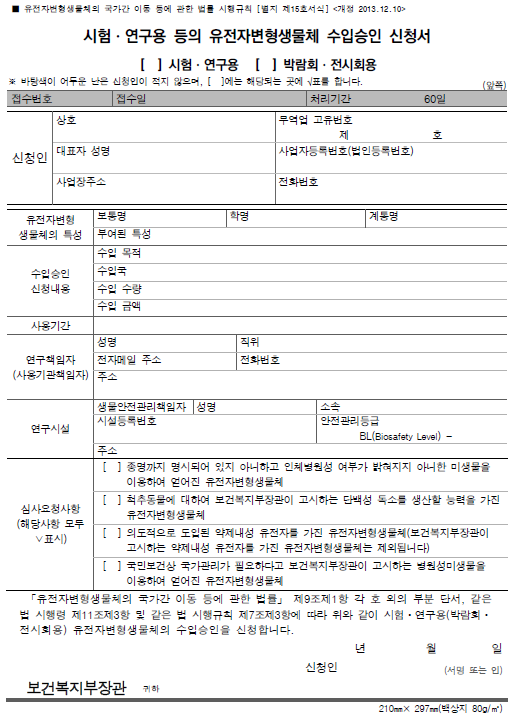
- ① 시험·연구용 등의 유전자변형생물체 수입승인신청서
- ② 수입계약서(수입대행계약서 포함) 또는 주문서 사본
- ③ 유전자변형생물체의 명칭·특성 및 용도에 관한 정보
- ④ 시험·연구용 유전자변형생물체 운반계획서
- ⑤ 시험·연구용 유전자변형생물체 안전관리계획서
- ⑥ 시험·연구용 유전자변형생물체 사용계획서
- ⑦ 정부 수입인지
- 행정 수수료용 발급 (2만원)
※ 해당 서식은 자료실에 첨부함 [바로가기]
- 시험·연구용 유전자변형생물체 국가승인 제도안내
처리기한(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
수입승인 사항의 변경
1) 변경신고, 변경승인 범위
| 변경신고 | 변경승인 |
|---|---|
| 유전자변형생물체법 제8조제3항의 '경미한 사항'에 해당할 경우 변경 신고대상 * 수입자의 상호·주소 또는 연락처 변경 |
'경미한 사항'에 해당되지 않는 사항 |
2) 변경신청 절차
- 신청서류: 변경신청서 또는 신고에서 제출 서류를 첨부하여 접수
- 제출방법: 전자문서 또는 이메일(공문 포함)
- 제출처: 질병관리청 생물안전평가과
- 처리기간(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
