contents area
유전자변형생물체국가안전관리
- 작성일2025-03-19
- 최종검토일2025-04-03
- 담당부서생물안전평가과
- 연락처043-719-8046
detail content area
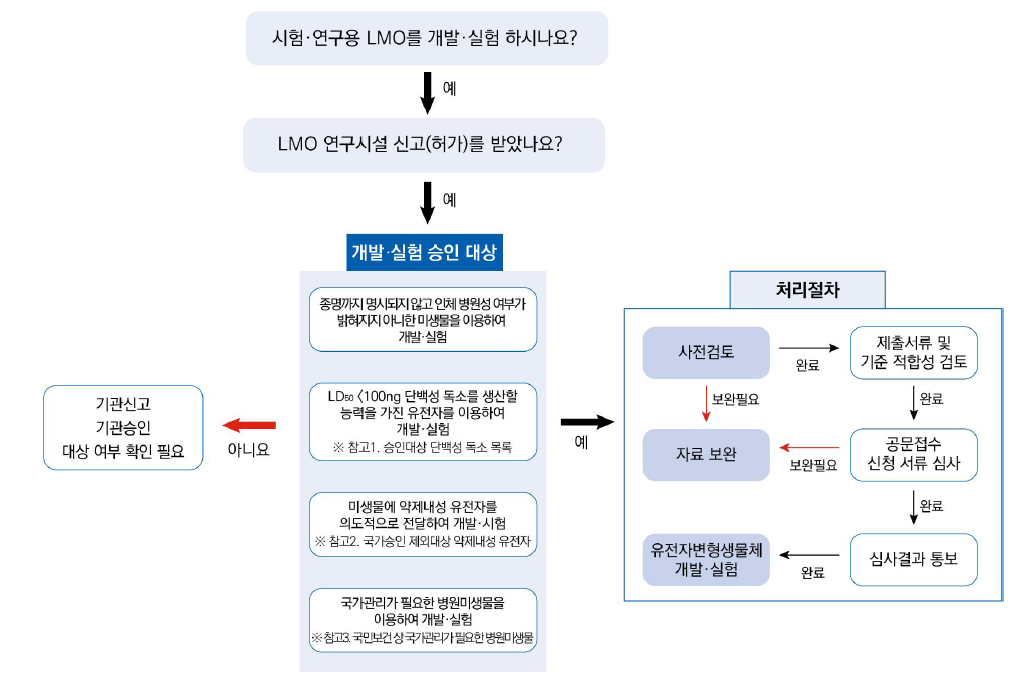
시험·연구용 유전자변형생물체 개발·실험 승인
위해 가능성이 큰 유전자변형생물체를 개발하거나 실험하는 경우, 질병관리청장의 사전 승인 필수
개발 실험 승인 대상
- 1. 종명까지 명시되어있지 아니하고 인체병원성 여부가 밝혀지지 아니한 미생물을 이용하는 경우
- 2. 척추 동물에 몸무게 1kg당 50% 치사독소량이 100ng 미만인 단백성 독소를 생산할 능력을 가지는 유전자를 이용하는 경우
- 유전자변형생물체법 통합고시 [별표 2-1]
※ 보툴리눔독소(A, B, C, D, E, F형), 파상풍독소, 이질신경독소, 디프테리아독소 등 - 3. 자연적으로 발생하지 아니하는 방식으로 미생물에 약제내성 유전자를 의도적으로 전달하는 경우
- 유전자변형생물체법 통합고시 [별표 2-2]
※ 승인제외 대상 약제내성 유전자
: Ampicillin, chloramphenicol, hygromycin, kanamycin, neomycin, puromycin, spectinomycin, streptomycin, tetracycline 또는 zeocin 내성 인정 숙주-벡터계를 이용하여 개발한 유전자변형미생물 - 4. 국민보건상 국가관리가 필요한 병원성미생물의 유전자를 직접 이용하거나 해당 병원성미생물의 유전자를 합성하여 이용하는 경우 - 유전자변형생물체법 통합고시 [별표 2-3] 바로가기
- 상용․시판되는 유전자변형 동물 및 식물 세포주(cell-line) 수입은 과학기술정보통신부에 수입신고
- 수입승인 받은 유전자변형생물체를 이용하여 유전자재조합 행위 없이 배양(증식)만 하는 경우도 개발·실험 승인 필요
개발·실험 승인 처리절차
[LMO 수입승인 절차]
- 질병관리청(수입 승인) - 국가관리가 필요한 시험연구용 LMO 수입
- 과학기술정보통신부(수입 신고) - 수입 승인사항 이외의 LMO
개발·실험 승인 제출 서류

[개발·실험 승인 제출 서류예시]
- ① 유전자변형생물체 개발․실험 승인신청서
- ② 시험·연구용 유전자변형생물체 사용계획서
- ③ 개발·실험의 위해성 평가자료의 제출 범위
- ④ 제출서류에 대한 증빙자료
※ 해당 서식은 자료실에 첨부함 [바로가기]
- 시험·연구용 유전자변형생물체 국가승인 제도안내
처리기한(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
개발·실험 승인 사항의 변경
1) 변경신고, 변경승인 범위
| 변경신고 | 변경승인 | |
|---|---|---|
| 범위 | 유전자변형생물체법 제22조의2제2항의
‘경미한 사항’에 해당할 경우 변경신고대상
ㆍ신청인의 사업장 주소, 연락처 ㆍ연구책임자의 성명, 주소, 연락처 ㆍ생물안전관리책임자의 성명, 주소, 연락처 |
∙공여체, 도입유전자, 숙주, 유전자 도입방법을 변경하거나 추가하려는 경우 ∙실험범위, 실험절차, 연구시설, 실험종사자 등 승인된 실험의 위해성에 영향을 미치는 주요사항을 변경하려 할 경우 ∙승인된 실험과정에서 비의도적으로 생산된 LMO를 승인된 실험범위 내에서 이용하려 할 경우 ※ 경미한 사항을 제외한 승인받은 내용을 변경하려는 경우 변경승인 받아야함. |
| 제출서류 | ① 개발・실험 승인사항 변경신고서 - LMO 법 시행규칙 [별지 제33호 서식] ② 유전자변형생물체 개발・실험 승인서 - LMO 법 시행규칙 [별지 제32호 서식] ③ 변경사유, 변경내용을 증명하는 서류 |
① 개발・실험 승인사항 변경신청서 - LMO 법 시행규칙 [별지 제33호 서식] ② 유전자변형생물체 개발・실험 승인서 - LMO 법 시행규칙 [별지 제32호 서식] ③ 변경사유, 변경내용을 증명하는 서류 |
2) 변경신청 절차
- 신청서류: 변경신청서 또는 신고에서 제출 서류를 첨부하여 접수
- 제출방법: 전자문서 또는 이메일(공문 포함)
- 제출처: 질병관리청 생물안전평가과
- 처리기간(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)




