Risk assessment for the use of healthcare-related living modified organisms
- Entities who wish to import, produce, or utilize LMOs for health and medical purposes must undergo a risk assessment by the Korea Disease Control Agency in accordance with Article 7-2 (1) of the Act on Transboundary Movements, etc. of Living Modified Organisms.
- The risk assessment of living modified organisms is evaluated through a comparative analysis with existing species (non-living modified host organisms).
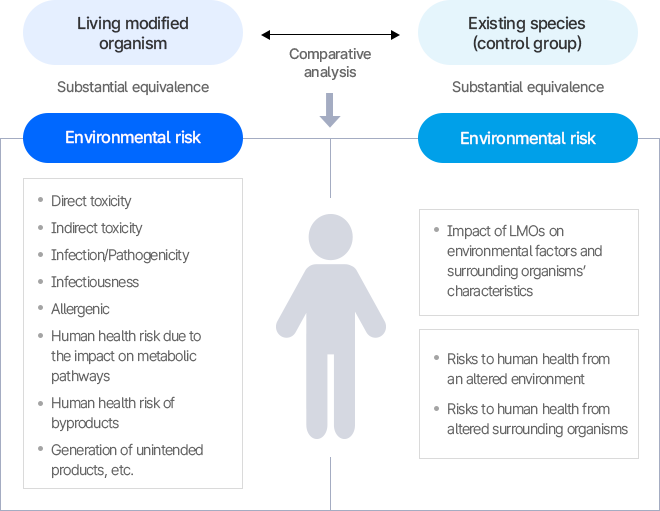
이 이미지는 유전자변형생물체(LMO)의 위해성 평가 과정을 개략적으로 보여준다. LMO와 기존 비교군을 비교 분석하여 인체 위해성과 환경 위해성을 구분한다.
- 인체 위해성:
- 직접적 독성
- 간접적 특성
- 감염원성 및 전염성
- 알레르기성
- 대사경로 영향
- 부산물의 인체 위해성
- 의도하지 않은 산물의 생성 등
- 환경 위해성:
- LMO가 환경요소 및 주변생물체 특성에 미치는 영향
- 변화된 환경이 인체에 미치는 위해
- 변화된 주변생물체가 인체에 미치는 위해
의미: 유전자변형생물체의 위해성 평가는 인체와 환경 두 측면에서 독성, 감염 가능성, 생태계 영향 등을 종합적으로 검토하는 절차임을 나타낸다.
Risk assessment procedure for living modified organisms for healthcare use
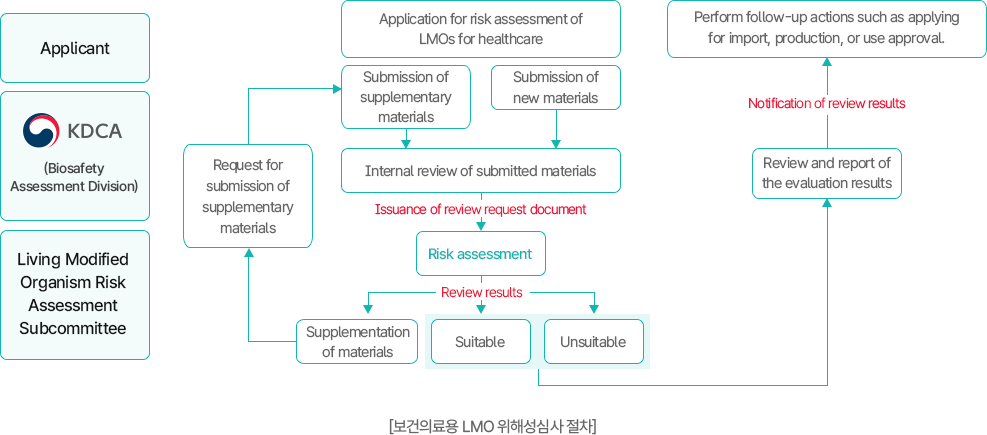
이 이미지는 보건의료용 유전자변형생물체(LMO)의 위해성 심사 절차를 나타낸 흐름도이다.
- 신청 단계: 신청인이 질병관리청(KDCA, 생물안전평가과)에 위해성평가를 신청.
- 자료 제출: 신규자료 제출 또는 보완자료 제출.
- 내부 검토: 제출자료에 대한 내부 검토 후 심사요청 공문 발송.
- 심사: 위해성심사 분과위원회에서 검토. 결과는 적합 또는 부적합으로 판정.
- 결과 처리:
- 적합 시 → 승인 및 후속 조치 가능.
- 부적합 시 → 심사 결과 통보 후 신청 반려.
- 후속 조치: 심사 결과에 따라 수입·생산·이용 승인 신청 등 후속 절차 진행.
의미: 보건의료용 LMO는 철저한 자료 제출과 검토, 위원회 심사를 거쳐 적합성 여부가 판정되며, 최종 결과에 따라 승인 또는 반려가 결정된다.
[보건의료용 LMO 위해성심사 절차]
Documents to be submitted for risk assessment of living modified organisms for healthcare use
-

- Application form for risk assessment of living modified organisms
- Submission table for risk assessment data
- Risk assessment data for living modified organisms
- Korean summary of the risk assessment report
- Supporting documents for submitted materials (references, standards, etc.)
- Government import approval - Issuance for administrative fees (4 million KRW)
- Safety management guide for living modified organisms
The risk assessment data submitted when applying for risk assessment of LMOs for healthcare use must meet the requirements specified in Article 5-2 of the “Consolidated Notice on the Transboundary Movements, etc. of Living Modified Organisms.
- Data published in professional journals
- Data tested according to Good Laboratory Practice (GLP) standards
- Data tested at domestic and international specialized institutions such as universities or research organizations, issued by the head of the institution, and reviewed to be deemed valid, which must include an overview of the research facility, major equipment, composition of research personnel, and the research experience of the testers
- Data submitted during the risk assessment of living modified organisms in foreign countries; documents must confirm that the foreign government has approved the use of living modified organisms
Application procedure for risk assessment of LMOs for healthcare use
- Application documents: Submit the application documents along with the application for risk assessment of living modified organisms.
- How to submit: Submit one printed copy and 12 electronic copies of the documents either by electronic mail or by post. If submitting by email, the original must be sent by mail.
- Where to submit: Biological Safety Assessment Division, Centers for Disease Control and Prevention
- Processing period (If there is a document supplementation period, the supplementation period is not included in the processing deadline.)
- Notification of results: Within 270 days
