보건의료용 유전자변형생물체의 위해성심사
- 보건의료용 목적으로 LMO를 수입·생산·이용하고자 하는 자는 「유전자변형생물체 국가간 이동 등 에 관한 법률」 제7조의2 제1항에 따라 질병관리청의 위해성심사 필수
- 유전자변형생물체의 위해성심사는 기존 종(유전자 변형되지 않은 숙주 생물체)과의 비교학적 분석을 통해 평가됨
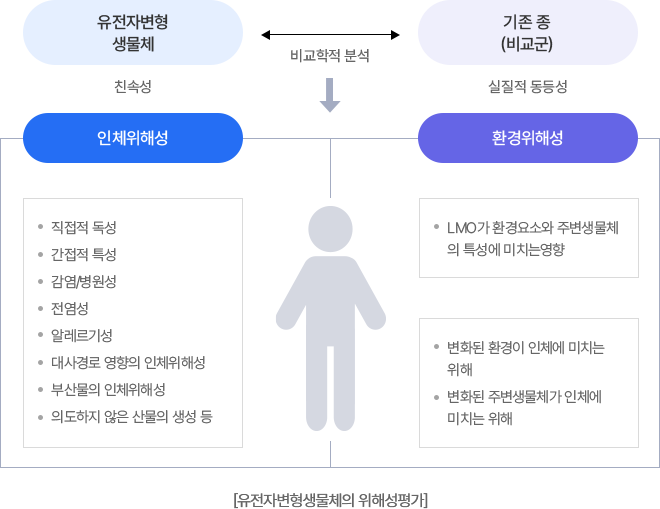
이 이미지는 유전자변형생물체(LMO)의 위해성 평가 과정을 개략적으로 보여준다. LMO와 기존 비교군을 비교 분석하여 인체 위해성과 환경 위해성을 구분한다.
- 인체 위해성:
- 직접적 독성
- 간접적 특성
- 감염원성 및 전염성
- 알레르기성
- 대사경로 영향
- 부산물의 인체 위해성
- 의도하지 않은 산물의 생성 등
- 환경 위해성:
- LMO가 환경요소 및 주변생물체 특성에 미치는 영향
- 변화된 환경이 인체에 미치는 위해
- 변화된 주변생물체가 인체에 미치는 위해
의미: 유전자변형생물체의 위해성 평가는 인체와 환경 두 측면에서 독성, 감염 가능성, 생태계 영향 등을 종합적으로 검토하는 절차임을 나타낸다.
보건의료용 유전자변형생물체의 위해성심사 절차
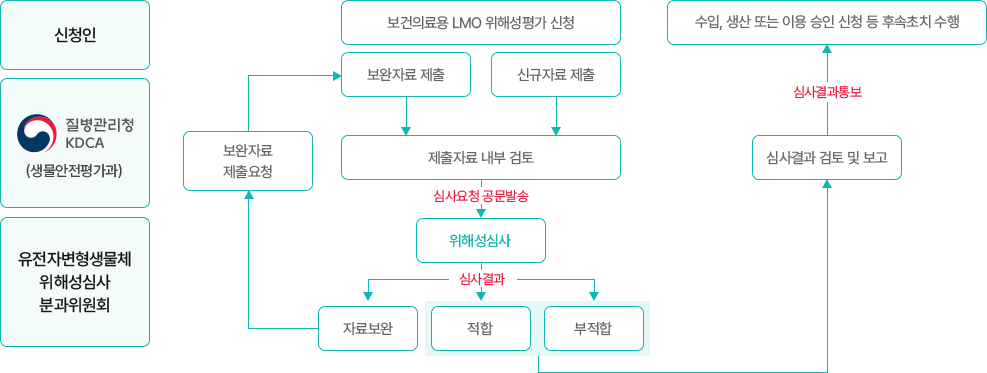
이 이미지는 보건의료용 유전자변형생물체(LMO)의 위해성 심사 절차를 나타낸 흐름도이다.
- 신청 단계: 신청인이 질병관리청(KDCA, 생물안전평가과)에 위해성평가를 신청.
- 자료 제출: 신규자료 제출 또는 보완자료 제출.
- 내부 검토: 제출자료에 대한 내부 검토 후 심사요청 공문 발송.
- 심사: 위해성심사 분과위원회에서 검토. 결과는 적합 또는 부적합으로 판정.
- 결과 처리:
- 적합 시 → 승인 및 후속 조치 가능.
- 부적합 시 → 심사 결과 통보 후 신청 반려.
- 후속 조치: 심사 결과에 따라 수입·생산·이용 승인 신청 등 후속 절차 진행.
의미: 보건의료용 LMO는 철저한 자료 제출과 검토, 위원회 심사를 거쳐 적합성 여부가 판정되며, 최종 결과에 따라 승인 또는 반려가 결정된다.
[보건의료용 LMO 위해성심사 절차]
보건의료용 유전자변형생물체 위해성심사 제출 서류
-

- 유전자변형생물체 위해성심사신청서
- 위해성평가자료 제출표
- 유전자변형생물체의 위해성평가자료
- 위해성평가서 한글요약문
- 제출자료에 대한 증빙자료(참고문헌, 표준품 등)
- 행정 수수료용 발급 - 행정 수수료용 발급(400만원)
- 유전자변형생물체 안전관리 가이드
보건의료용 LMO 위해성심사 신청 시 제출하는 위해성평가자료는 「유전자변형생물체 국가간 이동 등에 관한 통합고시」 제5-2조에 따른 요건을 충족해야함
- 전문학술지에 게재된 자료
- 우수실험실관리기준(GLP)에 의하여 시험하 자료
- 대학 또는 연구기관 등 국내외 전문기관에서 시험한 것으로 해당 기관의 장이 발급하고 그 내용(이 경우 연구기관의 시험시설 개요, 주요설비, 연구 인력의 구성, 시험자의 연구경력 등이 기재되어야 함)을 검토하여 타당하다고 인정할 수 있는 자료
- 외국에서 유전자변형생물체의 위해성 심사 당시 제출된 자료. 이 경우 그 외국 정부가 유전자 변형생물체의 사용을 승인하였음을 확인할 수 있는 자료
위해성평가 제출자료의 요건
보건의료용 LMO 위해성심사 신청 절차
- 신청서류: 유전자변형생물체 위해성심사신청서에 제출 서류를 첨부하여 접수
- 제출방법: 서류(인쇄본) 1부와 전자문서 12부를 포함하여 전자 공문 또는 우편으로 제출 이메일로 제출시, 원본은 우편으로 발송
- 제출처: 질병관리청 생물안전평가과
- 처리기간(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
- 결과통보: 270일 이내

